Химический состав соединительной ткани
Кроме того, в ней встречаются черные и бурые пигменты, получившие название меланинов. В состав соединительной ткани входят также жиры и липоиды, минеральные вещества, экстрактивные вещества, вода. Количество жиров, белков и минеральных веществ резко меняется в зависимости от вида соединительной ткани, например в жировой ткани очень много жира, а в костной — минеральных веществ.
Белки
В соединительной ткани различают следующие белки: коллаген, представляющий собой основной белок соединительной ткани, проколлаген, эластин, ретикулин, муцин, мукоид, альбумин, глобулин.
Коллаген и его производные
Коллаген — самый распространенный белок из группы протеиноидов. Он составляет основную массу межклеточного вещества соединительной ткани. Коллаген относится к фибриллярным белкам, частицы которых имеют форму вытянутых волокон или нитей, и образует в соединительной ткани крепкие и нежные переплетенные друг с другом волокна.
Коллаген, что означает «клейдающий», назван так потому, что при нагревании с водой переходит в клей или желатин.
Коллаген устойчив к воздействию различных веществ. Он не растворяется в холодной воде, растворах солей, слабых кислот и щелочей, в органических растворителях. Выполняя в теле животных механические функции, он является одним из наиболее устойчивых белков также в механическом отношении. Его волокна обладают значительной механической прочностью. Физические и химические свойства коллагена тесно связаны с его функцией в организме.
Коллаген с трудом поддается непосредственному изучению, так как ему присуща характерная определенная морфологическая структура, с нарушением которой теряется представление о коллагене. Поэтому при изучении свойств коллагена чаще всего пользуются не коллагеном, а его производным — желатином. Во многих случаях данные, полученные в опытах с желатином, переносят на коллаген.
Некоторые исследования возможно проводить с выделенными пучками коллагеновых волокон.
По сравнению с альбуминами, глобулинами и другими белками коллаген содержит повышенное количество азота, в среднем 17,8%. Поэтому коэффициент пересчета азота на белок для коллагена равен 5,62 (100/17,8) = 5,62).
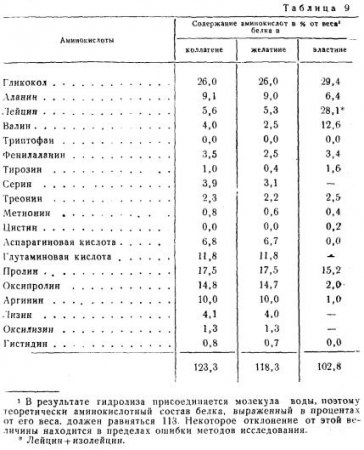
В табл. 9 приведен наиболее вероятный аминокислотный состав коллагена и эластина.
Из табл. 9 видно, что коллаген и желатин имеют близкий аминокислотный состав. Оба белка содержат очень большое количество гликокола и не содержат триптофана (незаменимая аминокислота) и цистина. Вследствие отсутствия триптофана коллаген и желатин являются неполноценными белками. Животные, получающие в пищу только желатин, погибают. Однако желатин может до известной степени предотвратить распад белковых веществ организма. Желатин, даваемый в пищу с недостающими в нем аминокислотами, может заменить полноценные белки пищи.
Коллаген способен удерживать очень большое количество воды: 100 г сухого коллагена при pH 5—7 поглощают 200 г воды. Другие волокнистые белки поглощают в этих же условиях следующее количество воды в г:

При смещении pH в кислую или щелочную сторону количество поглощаемой воды, а следовательно и набухаемость коллагена, резко увеличиваются. Это свойство используется в различных производственных процессах переработки сырья, содержащего коллаген.
Коллаген при обработке горячей водой переходит в желатин или клей. Это превращение — необратимый процесс, так как связано с нарушением морфологической структуры.
Желатин и клей, являясь производными коллагена, несколько отличаются друг от друга. В зависимости от условий обработки из коллагена можно получить желатин или клей. Клей отличается от желатина тем, что в нем содержится большое количество промежуточных продуктов распада желатина — полипептидов. Растворы желатина желируют при низких концентрациях, растворы клея — при высоких. Желатин не растворяется в холодной воде, а только набухает в ней, в теплой или горячей воде растворяется хорошо. При кипячении со слабыми кислотами, например 1%-ной уксусной, или при длительном воздействии горячей воды желатин, благодаря частичному гидролизу, теряет способность желировать.
Желатин осаждается спиртом, нейтральными солями, реактивами на алкалоиды. В отличие от альбуминов и глобулинов, он не осаждается минеральными кислотами, кроме метафосфорной, и большинством солей тяжелых металлов.
Желатин не дает реакции на триптофан и дает слабые ксантопротеиновую реакцию и реакцию Миллона. Вследствие отсутствия триптофана при гниении желатина не образуется скатола и индола.
Проколлаген
В 1948 г. советские ученые из кожи и органов многих животных выделили в кристаллическом виде белок, названный ими проколлагеном. Проколлаген отличается по ряду свойств от известных до сих пор белков.
По аминокислотному составу проколлаген близок к коллагену, но по растворимости, высаливаемости и другим свойствам отличается от него. При нагревании с водой проколлаген переходит в желатин. Предполагают, что проколлаген является тем материалом, из которого в организме образуются коллагеновые волокна.
В последнее время современными методами исследования — электронной микроскопией и рентгеноструктурным анализом — показано, что проколлаген является составной частью коллагена, которому приписывается комплексное строение.
Отделение проколлагена приводит к разделению коллагенового комплекса на два компонента — проколлаген и остаток, который назван колластромином. Оба белка связаны с полисахаридами.
Структура коллагенового комплекса показана на схеме:
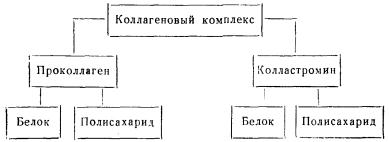
Различная устойчивость коллагенового комплекса разных тканей зависит не от. строения комплекса, а от наличия оболочек у волокон.
Эластин
Эластином называется белковое вещество, входящее в состав эластических волокон. Эластические волокна очень растяжимы и эластичны, желтоватого цвета, разветвляются и соединяются друг с другом. В живой ткани они являются тем фактором, который после растяжения приводит ткань в первоначальное состояние.
Подобно коллагену, эластин относится к протеиноидам.
В некоторых частях тела из скопления эластических волокон образуется эластическая или упругая ткань, свойства которой зависят от эластина. Эта ткань довольно распространена в организме. Она входит в состав соединительнотканных перепонок, стенок артерий и т. д. Выйная связка быка в основном со стоит из эластина. В состав шкуры животных эластин входит в незначительных количествах по сравнению с коллагеном (см. табл. 10).
Эластин значительно устойчивее коллагена. Он не растворяется в холодной и горячей воде, в растворах солей, разведенных кислотах и щелочах; чрезвычайно устойчив к воздействию различных растворителей; даже крепкая серная кислота на холоду действует на него очень слабо. Эластин расщепляется трипсином; пепсин на него не действует. Эластин отличается от коллагена по аминокислотному составу (см. табл. 9), а главное тем, что не образует желатина. Подобно коллагену, он не представляет собой вещества со строго определенными свойствами, Его свойства зависят от вида животного, органа, в строении которого он принимает участие, возраста животного и т. д.
Ретикулин
Ретикулин входит в состав ретикулиновых волокон, образующих сетчатые ячейки, в которых заложены кровеносные сосуды и клетки органов. Ретикулин мало изучен.
Ретикулин очень устойчив к действию горячей воды, не образует клея, в течение многих часов не растворяется в крепких кислотах и щелочах на холоду. Трипсин не действует на ретикулиновые волокна, пепсин расщепляет их. Глубокие изменения в ретикулине вызывает сернистый натрий.
Ретикулин способен восстанавливать соли серебра; при этом ретикулиновые волокна чернеют, что используется для их обнаружения.
Муцины и мукоиды
Муцины и мукоиды входят в состав соединительной ткани в небольших количествах, например, содержание их в шкуре составляет 0,1—0,3% в расчете на свежую дерму.
Только один вид соединительной ткани — слизистая соединительная ткань — в основной своей массе состоит из муцинов и мукоидов. У высших животных в более или менее видоизмененной форме эта ткань находится только в глазном яблоке.
Муцины и мукоиды довольно распространены в организме; наличием их обусловлены особые свойства слизи. Слизистая консистенция слюны зависит от содержания муцина.
Муцины и мукоиды являются сложными белками и относятся к глюкопротеидам. При распаде от них отщепляется углеводная группа. В качестве углеводной группы в состав муцинов и мукоидов чаще всего входят галактоза и глюкозамин.
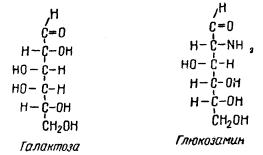
Глюкозамин можно рассматривать как переходное соединение от оксиаминокислот к глюкозе. Наличие остатка глюкозамина в молекуле глюкопротеидов указывает на один из возможных путей образования в организме углеводов из белков.
Как и все сложные белки, муцины и мукоиды растворяются 8 слабых щелочах. Разделение их основано на том, что муцины осаждаются из щелочного раствора крепкой уксусной кислотой, а мукоиды остаются в растворе. Муцины и мукоиды растворяются в спирте, дают все цветные реакции на белки, не свертываются при нагревании. Последнее свойство при неправильном проведении технологического процесса может привести к загрязнению топленого жира и желатина этими белками.
Альбумины и глобулины
При обработке соединительной ткани водой из нее извлекается небольшое количество белков типа альбумина, а при последующей обработке солевыми растворами — небольшое количество белков типа глобулина. Альбумины и глобулины входят в состав основного вещества и протоплазмы клеток.
В процессе предварительной подготовки сырья к выварке желатина большая часть альбуминов и глобулинов удаляется. При наличии этих белков желатин становится мутным, качество его ухудшается.
Меланины
Меланины откладываются в соединительной ткани обусловливают пигментацию кожи. Пигменты, также называемые меланинами и близкие по составу к меланинам соединительной ткани, окрашивают шерсть, волос, перья и др.
В организме меланины образуются ферментативным путем из тирозина. При гидролизе белков минеральными кислотами и щелочами получаются меланоидиновые вещества, сходные с меланинами.
Меланины очень разнообразны по составу и свойствам; получение их затруднительно и они мало изучены. Известно, что меланины содержат азот, не кристаллизуются, не растворяются в водных и солевых растворах. Некоторые представители меланинов растворяются в щелочах, другие не растворяются в них даже при кипячении. Меланины не изменяются под действием концентрированной соляной кислоты; дымящаяся азотная кислота обесцвечивает их, а теплая серная кислота растворяет. Некоторые меланины обесцвечиваются хлорной водой, перекисью водорода, сернистой кислотой.
Гиалуроновая кислота
Гиалуроновая кислота входит в состав основного межклеточного вещества соединительной ткани и является как бы цементирующим веществом. Установлено, что гиалуроновая кислота, содержащаяся в соединительнотканном слое шкуры, благодаря чрезвычайно высокой вязкости своих растворов препятствует при жизни животного проникновению бактерий. Часть гиалуроновой кислоты в соединительной ткани находится в свободном состоянии, часть связана с белками.
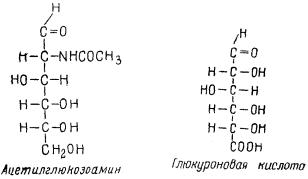
Гиалуроновая кислота относится к классу углеводов, к группе полисахаридов. Молекулярный вес ее очень высок (200000—500000); водные растворы отличаются исключительно большой вязкостью. Под действием фермента гиалуронидазы она распадается на ацетилглюкозамин и глюкуроновую кислоту. Этот фермент регулирует количество гиалуроновой кислоты в организме.
Гиалуронидаза встречается в семенниках, злокачественных опухолях, в яде змей, пчел, в некоторых бактериях, в том числе в бактериях, вызывающих мясные отравления.
Препараты гиалуронидазы вырабатываются преимущественно из семенников и используются в клинике в тех случаях, когда требуется повысить проницаемость тканей.
- Химия соединительной ткани
- Химизм мышечной работы
- Ферменты мышечной ткани
- Липоиды и жиры мышечной ткани
- Минеральные вещества мышечной ткани
- Экстрактивные вещества мышечной ткани
- Белки мышечной ткани
- Химия мышечной ткани
- Денатурация белков крови
- Использование крови для технических целей
- Использование крови для лечебных целей
- Использование крови для пищевых целей
- Порча крови
- Химический состав плазмы крови
- Гемолиз крови
- Химия эритроцитов
- Химический состав крови
- Постоянство состава и физико-химические свойства крови
- Дефибринирование крови
- Стабилизация крови
- Свертывание крови
- Химия крови
- Автолиз
- Гниение белков в кишечнике
- Обмен сложных белков
- Образование специфических веществ
- Декарбоксилирование белков
- Переаминирование белков
- Дезаминирование белков
- Синтез белков