Белки мышечной ткани
В дальнейшем миозин исследовали В. А. Энгельгардт, И. И. Иванов и другие советские ученые. Большой вклад в изучение мышечного сокращения внес венгерский ученый Сцент-Джордьи. Другой венгерский ученый Штрауб открыл белок мышц актин.
Изучение мышечной ткани следует начинать с белков, так как на их долю приходится около 80% сухого остатка мышечной ткани. В соответствии с морфологической структурой мышечного волокна белки распределяются следующим образом:
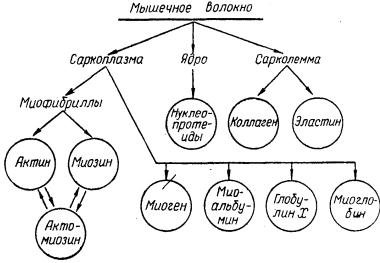
Из приведенной схемы видно, что белковый состав мышечной ткани очень разнообразен. В саркоплазме содержится четыре белка: миоген, миоальбумин, глобулин X и миоглобин. В миофибриллах содержится комплекс, состоящий из актина и миозина, называемый актомиозином. Все белки саркоплазмы называются внутриклеточными, а белки сарколеммы — внеклеточными, В ядрах содержатся нуклеопротеиды, в сарколемме — коллаген и эластин. Если учесть, что в мышечной ткани, кроме того, содержится еще значительное количество различных ферментов и каждый из них является особым белком, то белковый состав мышечной ткани оказывается еще более сложным.
Миозин
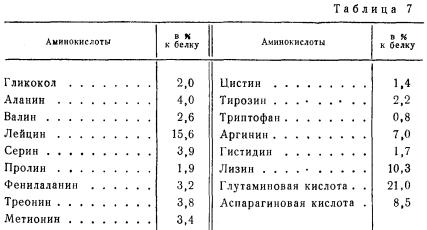
Основным белком мышечной ткани является миозин. Он составляет почти половину всех белков мышечной ткани, причем он встречается в мышцах всех млекопитающих, птиц и рыб. По пищевой ценности он является полноценным белком. В табл. 7 приведен аминокислотный состав миозина быка.
Миозин был детально изучен советскими биохимиками, обнаружившими, что он является не только структурным белком мышечной ткани, т. е. белком, участвующим в построении клетки, но и ферментом — аденозинтрифосфатазой, катализирующей реакцию гидролиза АТФ. При этом образуются АДФ (аденозинди-фосфорная кислота) и фосфорная кислота и выделяется большое количество энергии, используемой при мышечной работе.
Миозин получен в чистом кристаллическом виде. Молекулярный вес его очень большой, примерно 1,5 млн. Кристаллический миозин при полном отсутствии солей прекрасно растворим в воде. Ho достаточно добавить к воде ничтожное количество какой-либо соли, например хлористого натрия, как он полностью теряет способность растворяться и растворение наступает уже при концентрации хлористого натрия около 1%. Однако по отношению к солям, например к сернокислому аммонию, миозин ведет себя как типичный глобулин.
При извлечении белков мяса водой миозин не переходит в раствор. При обработке мяса солевыми растворами он обнаруживается в солевой вытяжке. При разведении водой солевого раствора миозина уменьшается концентрация соли и миозин начинает выпадать в осадок. Миозин высаливается при полном насыщении хлористым натрием и сернокислым магнием (высаливание производят кристаллической солью, иначе добиться полного насыщения невозможно).
Изоэлектрическая точка миозина находится при pH 5,4—5,5.
Миозин обладает свойством вступать в особые связи с различными веществами, в первую очередь с белками, с образованием комплексов. Особую роль в деятельности мышц играет комплекс миозина с актином — актомиозин.
Актин и актомиозин
Белок актин может существовать в двух формах: фибриллярной и глобулярной. В покоящейся мышце актин находится в фибриллярной форме; при мышечном сокращении он переходит в глобулярную. Большое значение в этом превращении имеют аденозинтрифосфорная кислота и соли.
В мышечной ткани содержится 12—15% актина. В раствор он переходит при длительном извлечении солевыми растворами; при кратковременном извлечении он остается в строме. Молекулярный вес актина около 75 000.
При смешивании растворов актина и миозина образуется комплекс, называемый актомиозином, из которого в основном построены миофибриллы. Этот комплекс отличается высокой вязкостью, способен резко сжиматься при определенных концентрациях ионов калия и магния (0,05 м KCl >и 0,001 м MgCl2) в присутствии аденозинтрифосфата. При более высоких концентрациях солей (0,6 м KCl) актомиозин при добавлении АТФ распадается на актин и миозин. Вязкость раствора при этом заметно снижается.
По представлениям Сцент-Джордьи сжатие актомиозина под действием АТФ лежит в основе сокращения живой мышцы.
Актомиозин, как подлинный глобулин, не растворим в воде. При обработке мяса солевыми растворами в раствор переходит актомиозин с неопределенным содержанием актина в зависимости от длительности извлечения.
Глобулин X
В мышечной ткани содержится около 20% глобулина X от всего количества белка. Он является типичным глобулином, т. е. не растворяется в воде, но растворяется в солевых растворах средней концентрации; осаждается из растворов при половине насыщения сернокислым аммонием (1 объем раствора белка и 1 объем насыщенного раствора сернокислого аммония), хлористым натрием при полном насыщении.
Mиоген
В мышечной ткани содержится около 20% миогена от всего количества белка. Его нельзя отнести к типичным альбуминам или глобулинам, так как он растворяется в воде, недостаточно высаливается хлористым натрием и сернокислым магнием при насыщении (кристаллической солью), в то же время осаждается сернокислым аммонием при 2/3 насыщения (1 объем белкового раствора и 2 объема насыщенного раствора сернокислого аммония). Этот белок был получен в кристаллическом виде. Молекулярный вес миогена 150 000.
В. А. Энгельгардт обнаружил у миогена способность катализировать одну из важнейших реакций, протекающих в процессе гликолиза мышечной ткани. Этим открытием впервые было показано, что ферментативной активностью могут обладать структурные белки, т. е. белки, участвующие в построении тканей.
Mиоальбумин
В мышечной ткани содержится около 1—2% миоальбумина от всего количества белка. Он является типичным альбумином, т. е. растворяется в воде, не осаждается хлористым натрием при насыщении, но осаждается сернокислым аммонием.
Mиоглобин
Миоглобин — сложный белок хромопротеид с молекулярным весом 16 900. При гидролизе он распадается на белок глобин и небелковую группу гем. Миоглобин окрашивает мышцы в красный цвет; от гемоглобина он отличается белковой частью; простетическая группа у них одинакова.
При окислении гем переходит в гематин, а в присутствии соляной кислоты — в гемин. По содержанию гемина можно судить о количестве миоглобина в мышечной ткани.
Содержание гемина в мышцах крупного рогатого скота колеблется от 42 до 60 мг на 100 г ткани; в мышцах свиней его значительно меньше — от 22 до 42 мг на 100 г ткани, поэтому они слабее окрашены.
Миоглобин, как и пигменты крови, имеют характерный спектр поглощения.
Принцип получения спектров поглощения окрашенных веществ, в частности пигментов мяса и крови, состоит в том, что световая энергия, проходя через раствор пигмента, поглощается этим раствором. При этом происходит так называемая абсорбция (поглощение) света, которую можно обнаружить спектроскопом.
Характерные полосы поглощения для пигментов мышечной ткани и крови находятся в пределах от 400 до 700 ммк. В этом интервале волны воспринимаются нашим глазом, и мы можем увидеть посредством спектроскопа в спектре темные полосы, получающиеся благодаря абсорбции света с определенной длиной волны.
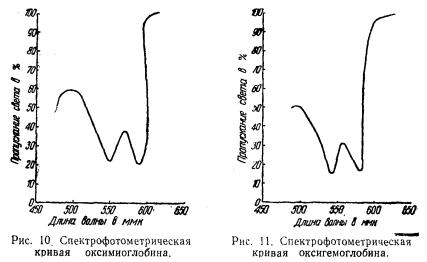
Поглощение света окрашенными веществами можно определить количественно спектрофотометром. Полученные результаты принято выражать графически. В этом случае по оси абсцисс откладывают длину волны света, а по оси ординат — количество света в процентах, прошедшее через раствор. Чем меньше прошло света, тем больше поглотилось его окрашенным веществом. Полное пропускание света раствором принимается за 100%.
На рис. 10 показано поглощение (абсорбция) света раствором оксимиоглобина; из него видно, что оксимиоглобин имеет две ярко выраженные характерные полосы поглощения в видимой области спектра, т. е. два участка, в которых он меньше всего пропускает света и, следовательно, больше всего поглощает света. Максимумы этих участков находятся при двух длинах волн; λ 585 ммк и λ 545 ммк,
На рис. 11 показана для сравнения спектрофотометрическая кривая оксигемоглобина.
Миоглобин обладает большей способностью связываться с кислородом, чем гемоглобин крови. Посредством миоглобина мышечная ткань снабжается кислородом. В работающих мышцах миоглобина содержится больше, так как в них окисление протекает интенсивнее. Известно, что мышцы ног сильнее окрашены, чем спинная мышца; мышцы работающих волов окрашены также сильнее, чем неработающих животных. Особенно это заметно у птиц, грудные мышцы которых, являясь нерабочими, почти не окрашены.
Коллаген и эластин
Коллаген и эластин — соединительнотканные белки не растворимые в воде и солевых растворах. Они образуют сарколемму — тончайшую оболочку мышечного волокна.
Нуклеопротеиды
Нуклеопротеиды — белки, составляющие клеточное ядро. Характерной особенностью их является способность растворяться в растворах слабых щелочей. Это объясняется тем, что в их молекуле содержится простетическая группа, имеющая кислотные свойства.
Разделение белков мышечной ткани
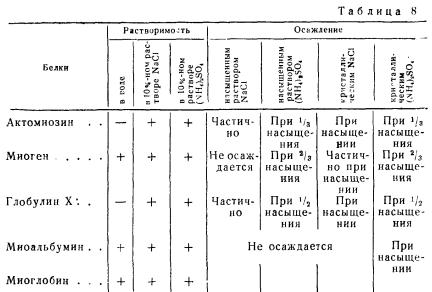
При обработке мышечной ткани солевыми растворами средней концентрации ее белки можно разделить на белки стромы и белки плазмы. Под стромой понимают не растворимую в солевом растворе структурную основу мышечной ткани, которая состоит главным образом из белков сарколеммы (см. схему).

Растворимость внутриклеточных белков мышечной ткани различна. Например, актомиозин и глобулин X не растворяются в воде и легче осаждаются из солевых растворов сернокислым аммонием и хлористым натрием, чем миоген. Миоген растворяется в воде подобно миоальбумину, но отличается от него по высаливаемости.
Растворимость белков мышечной ткани в растворах солей при нейтральной реакции и их осаждаемость приведены в табл. 8.
При посоле, варке и других видах технологической обработки мяса происходит потеря белковых веществ. Величины потерь белков обусловлены различными растворимостью и осаждаемастью их.
Зная свойства белков, можно подобрать такие условия, при которых потери будут наименьшими. Поэтому на изучение указанных свойств белков должно быть обращено особое внимание.
- Химия мышечной ткани
- Денатурация белков крови
- Использование крови для технических целей
- Использование крови для лечебных целей
- Использование крови для пищевых целей
- Порча крови
- Химический состав плазмы крови
- Гемолиз крови
- Химия эритроцитов
- Химический состав крови
- Постоянство состава и физико-химические свойства крови
- Дефибринирование крови
- Стабилизация крови
- Свертывание крови
- Химия крови
- Автолиз
- Гниение белков в кишечнике
- Обмен сложных белков
- Образование специфических веществ
- Декарбоксилирование белков
- Переаминирование белков
- Дезаминирование белков
- Синтез белков
- Обмен белков
- Обмен жиров и липоидов
- Связь между дыханием и брожением
- Обмен углеводов
- Всасывание
- Пищеварение
- Пищевые вещества