Химия эритроцитов
Большая часть гемоглобина находится в эритроцитах не в свободном состоянии, а образует со стромой подвижное, легко разрушаемое соединение. В крови содержится 10—12% гемоглобина. Строма от веса эритроцитов составляет всего 2,5%. В составе стромы содержится 70% белков и 25% липоидов.
Гемоглобин — сложный белок, состоящий из белка глобина и небелковой группы. Простетическая группа его известна под названием гем; в ее состав входит железо.
1 молекула гемоглобина содержит 4 атома железа и, следовательно, 4 гема. Молекулярный вес гемоглобина 68 000. По химической структуре гем представляет собой металлопорфирин, который в гемоглобине связан с белком глобином. Изоэлектрическая точка гемоглобина лежит при pH 6,74, а глобина — при pH 8,1.
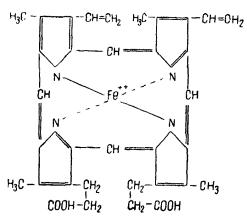
Строение гема у различных животных одинаково. Гемоглобины различаются по белковой части (глобину). Гем содержит двухвалентное железо, поэтому получить его в неизмененном виде очень трудно. Железо быстро окисляется, переходя в трехвалентное; при этом образуется так называемый гематин. Гем содержится в гемоглобине, оксигемоглобине, азоксигемоглобине, гематин — в метгемоглобине и других окисленных пигментах. Структуру гемоглобина и его производных (оксигемоглобина, метгемоглобина) можно изобразить следующим образом:
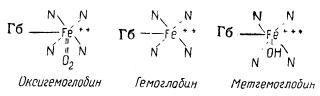
В этих схемах буквами N обозначены пирроловые ядра, знаками плюс — валентность железа, сплошными линиями — связь по основным валентностям, пунктирными — связь по дополнительным валентностям; Гб — глобин.
Оксигемоглобин OHb — соединение гемоглобина с кислородом ярко-красного цвета, образующееся при дыхании. Это соединение нестойкое. Кислород легко переходит в ткани, в которых происходит процесс внутреннего (клеточного) дыхания.
Процесс поглощения кислорода в легких гемоглобином, перенос его к тканям, поглощение кровью углекислого газа, образовавшегося в тканях и доставка его к легким, которыми он выделяется, называется наружным дыханием.
Гемоглобин обладает способностью легко соединяться не только с кислородом, но и с различными газами. В атмосфере, содержащей сотые доли процента окиси углерода, гемоглобин или оксигемоглобин переходит в карбоксигемоглобин СОНb, — соединение более прочное, чем оксигемоглобин. С таким явлением мы сталкиваемся при угаре; если с окисью углерода будет связано больше 50% гемоглобина крови животного, наступает смерть, так как оставшийся гемоглобин не может обеспечить организм кислородом.
Гемоглобин легко соединяется с окислами азота; при этом образуется азоксигемоглобин NOHb, соединение красного цвета. Такое явление наблюдается при действии нитрита в слабокислой среде.
При действии сильных окислителей гемоглобин переходит в коричневый метгемоглобин MHb, в котором железо содержится в окисленной форме (Fe+++). Метгемоглобин образуется при долгом стоянии крови на воздухе, при действии перекиси водорода, марганцевокислого калия, бертолетовой соли и др. При действии на оксигемоглобин H2S образуется сульфогемоглобин зеленоватого цвета. Присутствием сульфогемоглобима обусловлена зеленоватая окраска тушек птицы, иногда наблюдаемая при хранении.
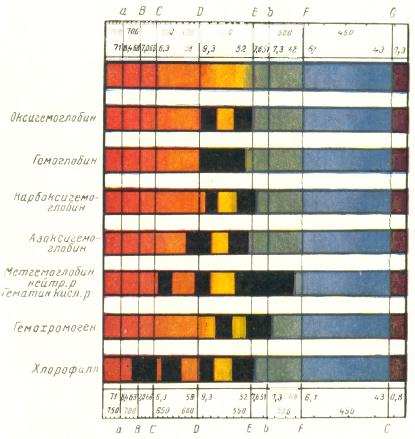
Гемоглобин и его производные — оксигемоглобин, метгемоглобин, карбоксигемоглобин, азоксигемоглобин и сульфогемоглобин — можно обнаружить по характерным для них спектрам поглощения (см. спектр).
- Химический состав крови
- Постоянство состава и физико-химические свойства крови
- Дефибринирование крови
- Стабилизация крови
- Свертывание крови
- Химия крови
- Автолиз
- Гниение белков в кишечнике
- Обмен сложных белков
- Образование специфических веществ
- Декарбоксилирование белков
- Переаминирование белков
- Дезаминирование белков
- Синтез белков
- Обмен белков
- Обмен жиров и липоидов
- Связь между дыханием и брожением
- Обмен углеводов
- Всасывание
- Пищеварение
- Пищевые вещества
- Классификация ферментов
- Свойства ферментов
- Химическая природа ферментов
- Ферменты
- Минеральные соли
- Полисахариды
- Дисахариды
- Моносахариды
- Углеводы