Свойства ферментов
Специфичность ферментов. Действие ферментов строго специфично. Тот или иной фермент действует только на определенное вещество или на определенный вид химической связи в молекуле, например пепсин — только на белки и не расщепляет жиры и углеводы, амилаза — на крахмал, но не оказывает действия на мальтозу.
Специфичность ферментов настолько велика, что возможность действия фермента обусловливается часто пространственным расположением атомов.
Например фермент, катализирующий реакцию превращения l-фенилаланина, не оказывает такого же действия на его пространственный изомер d-фенилаланин, т. к. не образуется комплекса фермента с субстратом, что видно из приведенной схемы.
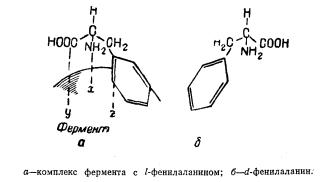
Предполагают, что специфичность действия ферментов зависит от белковой части, а простетическая группа не является специфичной и может, соединяясь с разными белками, участвовать в образовании ряда ферментов. Например, простетическая группа дегидразы молочной кислоты и простетическая группа дегидразы яблочной кислоты представляют собой одно и то же вещество.
Влияние температуры. Неустойчивость ферментов к влиянию высокой температуры является их характерным свойством. Сначала с повышением температуры скорость ферментативных реакций увеличивается. При достижении определенной температуры действие данного фермента будет наибольшим. Эта наиболее благоприятная температура называется оптимальной.
Оптимальной температурой для большинства ферментов, выделенных из тканей теплокровных животных, является температура тела (37—40°).
При дальнейшем повышении температуры скорость ферментативных реакций уменьшается и, наконец, при 80—100°, а для некоторых ферментов и при более низкой температуре, реакция прекращается. Уменьшение скорости ферментативной реакции при температуре, более высокой, чем оптимальная, объясняется постепенной потерей белком ферментативной активности вследствие изменений, чаще необратимых, происходящих с белками при действии повышенной температуры.
Влияние pH. Большое значение для действия ферментов имеет также концентрация ионов водорода. Активность ферментов резко меняется при изменении активной реакции среды. На рис. 3 показано влияние pH на процесс расщепления белка трипсином.
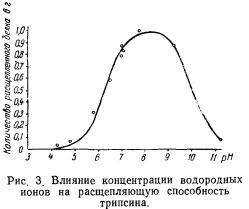
pH, при котором активность ферментов наибольшая, является оптимальным. Для каждого фермента существует оптимальный pH. Ниже приведены значения оптимальных pH для некоторых ферментов.

Активаторы и парализаторы. Химические вещества, способные повышать активность ферментов, называются активаторами, а химические вещества, действующие угнетающим образом, — парализаторами. Иногда вещество, являющееся парализатором для одного фермента, может быть активатором для другого.
Часто ферменты содержатся в тканях и клетках или выделяются из них в неактивной форме. Такие неактивные ферменты называются проферментами. При соответствующих условиях проферменты превращаются в активную форму, т. е. в ферменты.
- Химическая природа ферментов
- Ферменты
- Минеральные соли
- Полисахариды
- Дисахариды
- Моносахариды
- Углеводы
- Липиды
- Классификация белков
- Биологические особенности белков
- Изоэлектрическая точка белков
- Коллоидальная природа белков
- Молекулярный вес белков
- Денатурация белков
- Методы выделения белков
- Теории строения белков
- Способ связи аминокислот в белковой молекуле
- Аминокислоты
- Белки
- Химия важнейших веществ, входящих в состав организма животных
- Активная реакция среды
- Значение воды для жизни организма
- Элементарный состав организмов
- Понятие об обмене веществ
- Производство зубных щеток
- Производство гребней и расчесок
- Производство костяных (бельевых) пуговиц
- Сырье для производства предметов широкого потребления
- Производство желудочного сока
- Производство инсулина-сырца