Определение коллагеназной активности
Наиболее близкими к нативному коллагену субстратами в литературе считают коллаген, полученный из ахиллова сухожилия крупного рогатого скота или хвоста крыс очисткой по Бейкер и Лемпитт и по Лемпитт и др. Нативность субстрата определяют обычно по устойчивости его по отношению к трипсину.
Измерять коллагеназную активность можно взвешиванием нерастворенного остатка белка — субстрата или, наоборот, определением количества продуктов, перешедших в раствор.
В последнем случае могут быть использованы определения в супернатанте: общего азота по Кьельдалю, биуретовых продуктов или оксипролина. Спектрометрические измерения не рекомендуются при изучении коллагеназной активности, поскольку они основаны на определении ароматических аминокислот, содержание которых в коллагене незначительно.
Метод, базирующийся на анализах оксипролина, имеет преимущества в тех случаях, когда используют недостаточно очищенные субстраты, однако применять его для препаратов из тех микроорганизмов, которые образуют ферменты, участвующие в обмене оксипролина, нежелательно. Использование нингидринового теста также в определенной степени приводит к искажению результатов, так как при этом учитываются только свободные аминогруппы и не принимается во внимание молекулярный вес продуктов, образовавшихся в результате коллагенолиза.
Из многочисленных методов нами избран тот, в котором содержание продуктов расщепления коллагена определяют с биуретовым реактивом. Метод прост и дает воспроизводимые результаты.
Необходимые реактивы:
1. Ацетатный буфер pH 5,5 (0.176М по ацетату натрия);
2. Биуретовый реактив: к 42 мл насыщенного раствора едкого натра (без CO2) добавляют 300 мл воды; отдельно растворяют в 500 мл воды 1,5 г сернокислой меди и 6 г сегнетовой соли. Оба раствора сливают при перемешивании и добавляют воду до получения 1 л смеси;
3. Субстрат — коллаген.
Коллаген готовили из ахиллова сухожилия крупного рогатого скота по методу Лемпитт и Бейкера. Отобранное на мясокомбинате сухожилие очищали от мышечной ткани, жира и оболочек. Немедленно охлаждали и измельчали на волчке, полученную массу замораживали и лиофильно сушили. Далее высушенное сухожилие обрабатывали порциями по 4 г. При этом 4 г сухого сухожилия измельчали на кофейной мельнице и гомогенизировали в течение 1 мин в 150 мл раствора едкого натра для растворения посторонних белков. Суспензию центрифугировали и нерастворившуюся часть промывали 0,1 н. раствором едкого натра. Осадок коллагена отделяли центрифугированием. Затем его суспендировали в воде, осторожно нейтрализовали 0,1 н. раствором соляной кислоты, центрифугировали и осадок коллагена промывали водой. Потом коллаген гомогенизировали в течение 5 мин в 2000 мл 0,01 н. раствора соляной кислоты. Вязкий раствор отделяли центрифугированием от нерастворившихся частиц и осторожно нейтрализовали его 0,1 н. раствором едкого натра. Выпадающие при нейтрализации тонкие хлопья коллагена отделяли центрифугированием, промывали водой до отрицательной реакции на ион хлора. Волокнистый осадок суспендировали в 5 сменах этанола (по 150 мл), дважды промывали эфиром (по 100 мл) и сушили на воздухе. Полученную массу измельчали и использовали в качестве субстрата.
Определение коллагеназной активности производили таким образом. К 20 мг коллагена добавляли 5 мл раствора испытуемого фермента в буфере и инкубировали в течение 18 ч при 37° С. Кроме опытной, ставили еще 2 контрольные пробы; первый контроль — инкубация субстрата с буферным раствором; вместо раствора фермента, второй контроль — аналогичен опытной пробе, но без инкубации. По окончании инкубации пробы охлаждали в ледяной бане, фильтровали и в фильтрате определяли содержание растворимых продуктов переваривания коллагена. Для этого к фильтрату добавляли равный объем биуретового реактива и через 10 мин пробы колориметрировали с зеленым светофильтром против второго контроля. Об активности препаратов судили по величине экстинкцин (E). Для ориентировочного перевода E в проценты растворенного коллагена пользовались результатами расщепления коллагена под действием бактериальных препаратов коллагеназы. Процент растворения коллагена под действием этого фермента определяли весовым методом.
Ниже показано соотношение экстинкции фильтратов и процент растворенного коллагена в результате действия на него» бактериальной коллагеназы.
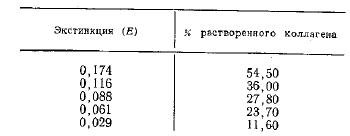
Для интенсивно окрашенных ферментных препаратов активность измеряли, определяя прирост азота в супернатанте.
- Определение эластазной активности ферментных препаратов
- Определение общей протеолитической активности ферментов
- Определение общего количества летучих редуцирующих веществ в мясе
- Изучение распределения в мясе пуринового азота по фракциям
- Метод исследования основного вещества внутримышечной соединительной ткани
- Определение развариваемости коллагена
- Методы исследования фибриллярных компонентов внутримышечной соединительной ткани
- Фракционирование как способ оценки лабильности соединительной ткани мяса
- Количественное определение N-концевых групп в белках фракции миозина
- Определение легкогидролизуемого фосфора АТФ методом ее осаждения солями ртути
- Определение активности актомиозина по Баленовичу и Штраубу
- Определение содержания азота белков, экстрагируемых солевым раствором
- Определение растворимости белков фракции миозина
- Определение перевариваемости in vitro белков мяса ферментами при последовательном воздействии пепсина и панкреатина
- Количественное определение свободных аминокислот мясного экстракта при помощи хроматографии на бумаге
- Определение количества трудноизвлекаемого («связанного») гликогена
- Определение общего количества гликогена по Пфлюгеру в модификации Вильштеттера
- Трилонометрический метод определения содержания в мясе кальция
- Определение содержания в мясе свободной и связанной воды по методу Грау и Гамма
- Сравнительная характеристика объективных методов определения жесткости мяса
- Интенсификация процесса улучшения консистенции при созревании быстроохлажденного говяжьего мяса путем его обработки препаратом протеолитического фермента фицина
- Технология применения протеолитических ферментов для размягчения мяса при производстве натуральных полуфабрикатов
- Фицин, его свойства и методы получения
- Изменения компонентов внутримышечной соединительной ткани
- Изменения мышечных белков
- Изменения нежности и гидратации мяса
- Изменения микроскопической картины строения тканей мяса
- Общие сведения о применении протеолитических ферментов для улучшения качества мяса
- Механизм протеолиза для улучшения консистенции мяса
- Обработка ультразвуком для повышения нежности мяса