Фицин, его свойства и методы получения
О наличии в плодах инжира подобной папаину протеазы упоминал еще Буткевич в 1898 г.
Позже Роббинс, исследуя латекс незрелых плодов инжира, определил, что содержащееся в нем активное начало, гидролизирующее казеин и яичный альбумин, представляет собой белок, легко разрушающийся при нагревании и, следовательно, имеющий ферментативную природу. Автор назвал его фицином (ficin) от латинского названия инжира Ficus carica. Краткий обзор свойств фицина и методов его получения нами был сделан несколько ранее.
Протеолитическая активность фицина, отнесенная к весу плодов, составляет 2% от активности, отнесенной к весу латекса. Последующими исследованиями были выяснены его основные свойства. Фицин относится к группе псевдоглобулинов, имеет молекулярный вес около 26000 и, как показали Уолти и Уайтейкер, при продолжительной выдержке очищенного латекса при pH 5,0 и температуре 5° С кристаллизуется, давая золотистые кристаллы (рис. 69).
Фицин относится К группе папаиназ. По данным Лайнеpa, он содержит в своей молекуле, по крайней мере, две сульфгидрильные группы, из которых только одна находится в каталитическом участке фермента. Кроме того, фицин содержит одну дисульфидную группу, которая не является существенной для его активности. По своему действию на белки фицин напоминает пепсин, так как катализируемое им расщепление белков доводится только до стадии полипептидов, имеющих отношение аминного азота к общему 25%.

Фицин осаждается спиртом, ацетоном и (NH4)2SO4 при 50% насыщения и частично адсорбируется на Аl(ОН)3.
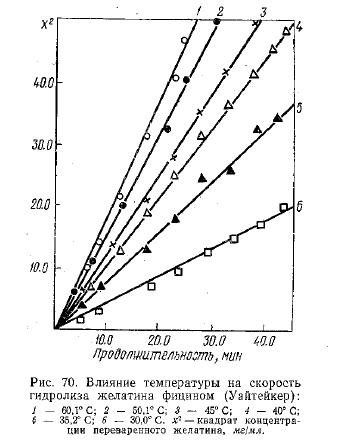
Температурный оптимум действия фицина находится при 63° С (рис. 70). При проведении опыта брали 200 мг желатина, 4 мкг фицина три pH 7,5.
Полная инактивация наблюдается в процессе нагревания при 75° С в течение 1 ч или при 80—85° С в течение 30 мин. Скорость инактивации растворов фицина нагреванием не следует кинетике уравнения первого порядка. Теплота инактивации составляет 71,700 кал на 1 моль. Фермент является устойчивым в интервале pH 4,5—9,5, причем исключение составляет узкий участок около pH 8,0, в котором его устойчивость понижена. Фермент разрушается разбавленной соляной кислотой при pH ниже 2,0.
Согласно Коэну, константа седиментации фицина равняется 2,665, а его изоэлектрическая точка находится при pH 9,0, по другим данным — около 5,0.
Как сообщил Накао, в латексе инжира содержатся, по крайней мере, три компонента, обладающих протеолитической активностью: протеиназа, пептидаза, действующая на пептон Витте, и пептидаза, расщепляющая dl-лейцилдиглицин и бензоилглицилглицин, но не действующая на дипептиды. Первый из этих компонентов представляет наибольший интерес с точки зрения использования фицина в мясной промышленности. Кроме того, Уайтейкер представил данные, указывающие на то, что в неочищенном препарате фицина находятся два фермента, обладающие протеиназной активностью. Эти данные были подтверждены Мессингом и Ван Нессом. Они разделили при помощи электрофореза белковые вещества, содержащиеся в препаратах фицина, на 6 фракций и показали, что 3 из них обладают протеолитической активностью и одна пероксидазной, а две неактивные.
По мнению авторов, выделенные ими 3 протеолитические фракции являются различными по своей природе ферментами. По всей вероятности, неоднородность коммерческих образцов фицина по содержанию в них протеолитических фракций, на которую может оказывать влияние сорт инжира и время сбора латекса, является одной из причин некоторого расхождения данных различных авторов относительно оптимальных условий pH для действия фицина. Так, по Уайтейкеру, скорость гидролиза желатина фицином является максимальной при pH 7,5, а по Робинсу и Накао — при pH 5,0—5,5. Оптимум pH для гидролиза казеина, эдестина, яичного альбумина, гемоглобина и некоторых синтетических субстратов колеблется между 6,5 и 7,5.
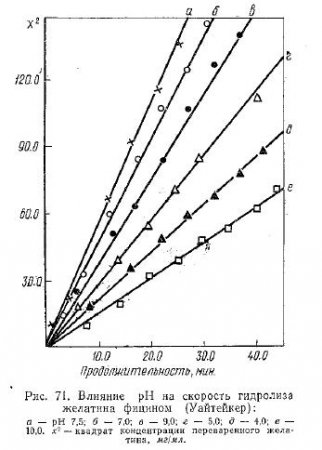
Данные Уайтейкера о влиянии pH на скорость гидролиза желатина фицином при 35° С представлены на рис. 71. Условия опыта: 200 мг желатина, 16 мкг фицина при 35° С. Применявшиеся буферные растворы: pH от 3,0 до 6,0 — 0,20 M цитрат; pH 7,0—7,5 — 0,20 M фосфат; pH 9,0—10,0 — 0,20 M борат.
Было также найдено, что энергия активации для гидролиза желатина фицином равняется 6050 кал/мопъ в температурном интервале от 40 до 55° С.
По данным Уайтейкера, хранение растворов фицина при -25° С в течение 60 дней приводит лишь к очень незначительной потере его активности, причем замораживание и оттаивание его растворов не оказывают никакого влияния на активность.
В процессе 17-дневного хранения растворов при комнатной температуре теряется 69,6% активности фермента. Полученные автором данные показывают, что фермент становится неактивным при комнатной температуре по двум причинам:
1. Имеется обратимая потеря активности из-за окисления SH-групп.
2. Происходит необратимая потеря активности, связанная с разрушением фермента.
Цистеин активирует фицин в концентрациях 0,005—0,05 М, а KCN дает максимальное активирование при 0,015 M, причем активация фицина цистеином происходит во времени и полностью завершается только через сутки.
Активирующими свойствами обладают также димеркаптопропанол, сероводород, версен.
Роль сульфгидрильных соединений, HCN и других указанных веществ заключается в предохранении фермента от окисления или соединения с тяжелыми металлами. Мацуяма и Шимура полагают, что HCN активирует пептидазное действие фицина, а цистеин — протеиназное.
По данным Ушино и Кояма, соли Sn" в концентрациях 10в-2 M активируют фермент, в то время как Cd, Mg, Al и Sn'''' в концентрациях от 10в-4 до 10в-2 M не оказывают никакого влияния. Согласно Яффе, гипосульфит при концентрации 0,0025 M. Является активатором фицина, при этом реакция активирования протекает в стехиометрических соотношениях и на 1 моль фицина требуется 1 моль гипосульфита.
С другой стороны, активность свежего латекса инжира, определяемая по свертыванию молока и расщеплению желатина, ингибируется гипосульфитом.
Для аналитических целей весьма важно то обстоятельство, что, как установили Эндрьюс и Кориатцер, хлороформ не отравляет этот фермент.
Исследования показали, что ингибиторами для фицина являются: полипептиды, образующиеся при гидролизе субстрата, перекись водорода, соли Cu, Hg, Co и Mn, сорбиновая кислота в концентрации 10в-4 M, монойод и монохлоруксусные кислоты, фенилгидразин. В кровяной плазме содержится ингибитор фицина, активное начало которого имеет белковую природу. Диализ в аэробных условиях в течение суток приводит к полной потере активности фермента, в то время как проведение этого процесса в анаэробных условиях не оказывает влияния на активность. Весьма важным в практическом отношении является вопрос о зависимости протеолитической активности латекса от стадий вегетационного периода и сорта инжира. Некоторые результаты этих исследований, проводившихся Уайтейкером, приведены в табл. 54, в которой показано, как влияет степень зрелости плодов различных сортов инжира на содержание в них фицина.
Из приведенных данных видно, что протеолитическая активность плодов различных сортов инжира неодинакова. Автор также проверил активность фицина в зеленых плодах 29 разновидностей инжира и показал, что она колеблется в еще более широких пределах, превышая в отдельных сортах в 5 раз минимальное значение. Все эти данные относятся к сортам инжира, выращиваемым в США. Сведений о характеристике отечественных сортов инжира по их протеолитической активности не имеется. Однако Гонашвили сообщил, что все образцы млечного сока инжирного дерева, взятые в Закавказье в августе—сентябре, обладают мощной протеолитической активностью.
Далее из табл. 54 следует, что максимальная активность фицина наблюдается в плодах, находящихся в очень зеленом состоянии. Некоторое снижение активности на единицу веса плодов при их переходе от очень зеленого до зеленого состояния может быть объяснено повышением содержания в них сахаров и относительным уменьшением количества общего азота. Крупные зеленые плоды инжира содержат наибольшее количество фицина на один плод. По мере того, как плоды достигают состояния восковой спелости, их протеолитическая активность резко снижается во всех изучавшихся сортах. Это снижение уже не может быть объяснено вышеуказанной причиной и, очевидно, при этом имеет место истинное понижение активности фермента.
Однако в большинстве случаев активность не исчезает полностью даже в спелых плодах. Наличие сезонных колебаний в количестве фермента на единицу объема сока инжира было показано также Роббинсом.
На основании изучения кинетики катализируемого фицином гидролиза ряда субстратов в различных условиях Хаммонд и Гутфройид пришли к выводу о том, что окисление SH-групп фицина в —S—S—группы инактивирует фермент. Однако такая инактивация является обратимой, и утраченная активность может быть восстановлена добавлением цистеина или других тиоловых соединений. Как отмечает Уайтейкер, фицин в плодах инжира не находится полностью в своей активной форме.
Так, в зеленых плодах активная форма фицина составляет около 75% от его общего содержания и снижается приблизительно до 50% для плодов, находящихся в стадии восковой спелости, и до 20—30% для спелых. Это указывает на то, что по мере созревания фруктов в них уменьшается содержание естественных активаторов фицина (по предположению Яффе — глютатиона).
Ванг и сотрудники, применив гистологический метод исследования, нашли, что фицин, папаин, бромелин и трипсин при их применении в высоких концентрациях (2,5—5,0%) обладают при 23—25° С коллагеназной активностью, в то время как изучавшиеся авторами ферменты микробного происхождения имеют очень небольшую коллагеназную активность или же совсем ею не обладают.
Мияда и Таппель сообщили, что фицин, папаин, бромелин, трипсин и розим П-11 в течение 1 ч инкубации при 60° C производят заметное расщепление коллагена высушенной сублимацией двуглавой мышцы бедра. Шерри и сотрудники нашли, что папаин и фицин переваривают коллаген при pH 2,0—4,5. При этом они представили данные о том, что нативный коллаген при низком pH претерпевает обратимое изменение, которое делает его восприимчивым к действию этих ферментов.
Наконец, исследованием Хайнричса и Уайтейкера эти разрозненные данные были подтверждены и, кроме того, выяснено, что фицин не может гидролизовать нативный коллаген. Коллаген может быть подвергнут деградации этим ферментом только после денатурации нагреванием, низким pH или высокими солевыми концентрациями. Денатурация вызывает набухание коллагеновых волокон, в результате чего фермент может проникать в них и расщеплять коллаген. Весьма важно, что повышение концентрации NaCl от 0 до 0,4 M увеличивает за 30 мин растворение коллагена при 35° С и pH 7,0 от 3,2 до 7,02%. По мере увеличения в мясе концентрации NaCl до 0,43 н. возрастает HS 120% степень растворения коллагена фицином. Было отмечено увеличение в два раза расщепления коллагена фицином в присутствии 0,2 M аргинина при вышеуказанных условиях инкубации.
Следующие данные этих авторов характеризуют интенсивность расщепления коллагена фицином при pH 5,5 и при различной температуре:

При сдвиге pH в кислую сторону до 2,6 растворение коллагена фицином при 25—45° С значительно усиливается. Однако при 60° С активирующего действия высокой концентрации водородных ионов не наблюдается. Как отмечают Эльгарбави и Уайтейкер, изменения температуры имеют большее влияние на растворение белков соединительной ткани, чем мышечной. Эти данные объясняют значительное воздействие фицина на коллаген мяса в процессе тепловой обработки последнего.
Фицин имеет также высокую эластолитическую активность. При этом эластин растворяется фицином и бромелином намного легче, чем коллаген при температурах до 40° С. Как было установлено Томасом и Партриджем, белки, обусловливающие эту активность при помощи электрофореза, не могут быть отделены от протеолитического фермента, содержащегося в препарате фицина. Следовательно, фицин не содержит отдельного фермента эластазы, а обладает эластолитическим действием. Ятко-Мансо и Уайтейкер пришли к заключению, что степень расщепления фицином пептидных связей в эластине коррелируется с количеством связей, образованных глицином. Растворение эластина фицином ингибируется высокими концентрациями цистеина йодацетатом в концентрации 1*10в-3 М.
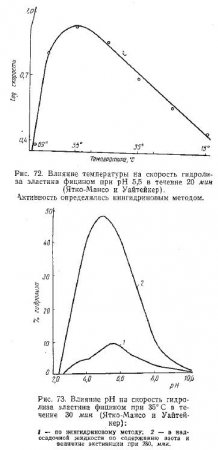
Поваренная соль оказывает некоторое положительное влияние на растворение эластина фицином, но даже в ее отсутствие эластин расщепляется этим ферментом, Фицин имеет максимум эластолитической активности при pH 5,5 и 55° С (рис. 72 и 73). Однако, даже при 20° С, эластин в значительной мере гидролизуется фицином.
Ятко-Мансо и Уайтейкер отмечают, что фицин растворяет эластин благодаря расщеплению значительного количества пептидных связей. При оптимальных условиях проведения реакции фицином расщепляются приблизительно 18% пептидных связей эластина. Для растворения эластина фицином не требуется предварительной денатурации субстрата.
Фицин так же, как папаин, бромелин, трипсин и розим П-11, очень активен по отношению к гидролизу полноценных белков мяса и быстро переваривает актомиозин.
Эль Гарбави и Уайтейкер изучали расщепление щелочерастворимых белков мышечной ткани крупного рогатого скота фицином и бромелином.
Они установили, что имеется небольшое, но заметное растворение белков говяжьего мяса фицином и бромелином даже при 0° C, причем изменение температуры оказывает большее влияние на растворение коллагена и эластина, чем на расщепление щелочерастворимых белков. То же можно сказать и о влиянии поваренной соли.
Способы получения препаратов фицина основаны на добыче латекса и различаются по методам его очистки.
Латекс инжира добывается главным образом в странах Южной Америки, и для его сбора применяют весьма архаический способ: дикорастущие фиговые деревья срезаются и сочащийся из их стволов латекс собирается. При отстое он разделяется на липидный и водный слои, и последний из них высушивается на солнце. Высушенный порошок поступает в продажу как коммерческий препарат фицина.
Шеринг запатентовал интересный способ очистки сырых малоактивных порошков папаина, фицина и других аналогичных ферментов путем экстракции активного начала водным раствором роданида калия.
Из полученных таким способом экстрактов ферменты осаждают добавлением спирта в присутствии ионов Zn или других тяжелых металлов при pH 6,5.
Осадок отделяют, подвергают диализу, стерильно фильтруют диализат и получают сухой очищенный препарат лиофилизацией. По сообщению Шеринга, полученные описанным способом препараты имеют полную растворимость в дистиллированной воде и сохраняют свою активность длительное время при 20° С.
Тбилисским институтом вакцин и сывороток получен очищенный двойным переосаждением ацетоном фицин из латекса, добытого путем подсечки листьев инжира. Однако, несмотря на высокий выход фермента (по данным Левандовской около 16%), такой способ, несомненно, чрезвычайно трудоемок и не применим в промышленном масштабе.
Отмеченная способность фицина воздействовать на белковые компоненты как мышечной, так и соединительной тканей делает приготовленные из него препараты высокоценными для улучшения качества мяса.
- Изменения компонентов внутримышечной соединительной ткани
- Изменения мышечных белков
- Изменения нежности и гидратации мяса
- Изменения микроскопической картины строения тканей мяса
- Общие сведения о применении протеолитических ферментов для улучшения качества мяса
- Механизм протеолиза для улучшения консистенции мяса
- Обработка ультразвуком для повышения нежности мяса
- Ускорение расслабления окоченения путем введения минеральных добавок
- Ускоренное созревание мяса при повышенной температуре с применением антибиотиков
- Ускорение созревания мяса при повышенной температуре с применением УФЛ
- Методы, основанные на ускорении развития послеубойного окоченения
- Демотация убойного скота
- Адренализация убойного скота
- Изменения питательной ценности мяса в процессе созревания
- Изменения летучих редуцирующих веществ в процессе созревания мяса
- Перераспределение пуринового азота по фракциям
- Изменения нежности в процессе созревания мяса различных видов животных
- Гипотезы о сущности процесса улучшения консистенции мяса при его созревании
- Динамика показателей, характеризующих состояние белковых компонентов внутримышечной соединительной ткани
- Динамика показателей, характеризующих состояние миофибриллярных белков
- Динамика показателей, характеризующих состояние саркоплазматических белков
- Изменения в белковой системе мяса в целом
- Физико-химические изменения в процессе созревания мяса
- Микробиологические изменения в процессе созревания мяса
- Органолептические изменения при созревании мяса
- Автолиз мышечной ткани в асептических условиях
- Тепловое окоченение и окоченение при оттаивании
- Особенности окоченения в различных мускулах и в мышечной ткани разных видов животных
- Изменения гидратации мышц
- Образование актомиозинового комплекса