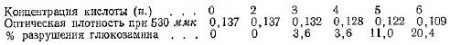Метод исследования основного вещества внутримышечной соединительной ткани
Несомненно, что степень полимеризации межуточного вещества, прочность связи его с фибриллярными компонентами и комплексность с другими белками зависят от возраста животного и многих других факторов и имеют большое влияние на соединительную ткань мяса (ее лабильность и физико-химические свойства). Если рассматривать соединительную ткань как морфологическое целое из коллагеновых и эластиновых волокон, сцементированных основным веществом и как бы погруженных в него, то даже самые чувствительные методы определения фибриллярных компонентов не в состоянии будут достаточно полно объяснить причины ее изменений.
В исследованиях, проводимых для медицинских целей, почетное место занимает гистохимический метод оценки межуточного вещества. С целью выявления полисахаридов основного (межуточного) вещества чаще других Применяют реактив Шиффа (лейкофуксин). Дифференциальную оценку кислых мукополисахаридов, таких как гиалуроновая и хондроитинсерная кислоты, осуществляют метахроматическим окрашиванием их с помощью основных красителей тиазиновой группы (толуидин блау, тионин и др.).
Однако гистологическим методом можно выявить лишь наличие и направление изменений исследуемого компонента, а не вскрыть их биохимическую сущность.
Аналитически мукополисахариды в биологических объектах оценивают по их составным частям (аминосахара, гексуроновая кислота) либо путем препаративного выделения из исследуемой ткани. Преимущество последнего то, что этот способ дает возможность анализировать физические и химические свойства выделенных веществ, их состав и структуру.
При выделении мукополисахаридов неизбежны как потери веществ, так и изменения, вызываемые даже очень осторожной обработкой. Поэтому, несмотря на большое количество методов, предложенных для выделения мукополисахаридов, широкого распространения они не получили. При исследовании такого объекта, как мышечная ткань, выделить мукополисахариды еще труднее, так как их содержание очень невелико.
Удовлетворительный метод для определения гексозаминов как составной части мукополисахаридов в биологических объектах предложили в 1933 г. Эльсон и Морган. Основа его — конденсация гексозаминов с ацетилацетоном или этилацетатом с образованием производных пиррола и затем развитие красной окраски с пара-диметиламинобензальдегидом.
Методы, разработанные позже, представляют собой модификации метода Эльсона и Моргана и направлены на устранение помех и улучшение условий проведения реакций, связанных с образованием окраски.
При практическом применении метода Эльсона и Моргана было обнаружено, что гидролизаты, приготовленные из различных растительных и животных тканей, содержат большое количество веществ, проявляющих себя в данном случае как хромогены со спектром поглощения, близким производным гексозаминов.
Были предложены различные способы устранения влияния этих помех: обработка гидролизатов «основным реактивом», содержащим концентрированную трихлоруксусную кислоту, хлористый и едкий натр, отгонка летучих хромогенов, образующихся при реакции ацетилирования, хроматография на катионообменных смолах.
Бос подробно исследовал условия, необходимые для получения оптимальных результатов количественного определения гекеозаминов в тканях и органах животного. Его данные положены в основу исследований, проводившихся позже. Метод Боса был успешно применен в исследованиях Касавиной и Зенкевич.
При проведении гидролиза на кипящей водяной бане Бос определил потери гексозамина за 15 ч в зависимости от концентрации кислоты.
Сравнивая результаты гидролиза образцов плазмы, печени, желез, соединительной ткани, Бос установил также, что оптимальное время гидролиза зависит от вида гидролизуемой ткани.
По нашим данным, при гидролизе мяса на кипящей водяной бане в 4 н. растворе HCl получаются следующие результаты:
данных условиях гидролиза составляет 1 ч.
Гидролиз проводишь в стеклянных пробирках с пришлифованными пробками. Кислоту брали в 35-кратном количестве по отношению к количеству белка в навеске.
Для гидролиза использовали 2 г навески измельченного мяса или аликвотную порцию экстрактов фракций I, II, III — 10 мл.
По окончании гидролиза пробирки охлаждали, и гидролизаты подвергали очистке на катионообменниках.
По данным Боса, на колонку длиной 25 см и диаметром 1 см, содержащую 5 мл суспензии Дауэкс-50 в воде (1:1), единовременно можно дать в зависимости от концентрации соляной кислоты в испытуемом гидролизате 10 мл 0,25 н., 5 мл 0,5 н. или 2 мл 1 н. солянокислотного гидролизата.
Бос определил, что скелетная мышца крысы содержит меньше 28 мг % гексозаминов к весу сырой ткани. Наши предварительные опыты также показали небольшое содержание гексозаминов в мясе. Поэтому для приведения гидролизатов к желаемой кислотности (0,25 н. HCl) мы проводили их выпаривание в вакууме до сухого состояния с последующим разведением остатка в кислоте соответствующей крепости.
В катионообменник вносили 10 мл полученного таким образом раствора.
При прохождении гидролизатов через колонку гексозамины адсорбируются катионитом, а многие мешающие вещества проходят через нее и дополнительно вымываются водой. На колонке задерживаются гуминовые вещества, которые вымываются щелочью уже после элюирования гексозаминов.
После прохождения гидролизата колонку промывали 10 мл дистиллированной воды, а затем элюировали гексозамнны 7 мл 2 н. раствора HCl и элюат собирали в мерные цилиндры или колбы объемом 10 мл. По окончании сбора элюат нейтрализовали 2 и. NaOH до розового окрашивания по фенолфталеину, затем 1 н. HCl по каплям до исчезновения розовой окраски. При этом количество добавленной щелочи и кислоты учитывали для того, чтобы в дальнейшем можно было уравнять концентрацию соли, оказывающей влияние на ход определения. Нейтрализованный, совершенно бесцветный и прозрачный элюат доводили дистиллированной водой до объема 10 мл.
Для определения гексозаминов употребляли следующие реактивы:
1. Ацетилацетон, подвергнутый перегонке в вакууме, бесцветный 2%-ный раствор в 1 н. Na2CO3; 2. Пара-диметиламинобензальдегид, перекристаллизованный из этилового спирта, 2,7%-ный раствор в смеси этилового спирта и концентрированной HCl в отношении 1:1 (реактив Эрлиха); 3. NaCl — 4 н. раствор; 4. Na2CO3 — 1 н. раствор.
Использовали пробирки из нейтрального стекла с пришлифованными пробками.
В них наливали 1,5 мл испытуемого элюата. Параллельно с испытуемыми брали стандартные растворы глюкозамина в концентрациях, близких к ожидаемым в опытных растворах. В контрольные пробирки вместо испытуемого раствора брали дистиллированную воду. Во все пробирки приливали рассчитанный объем 4 н. раствора поваренной соли (так, чтобы после доведения объема до 3 мл получился 2 н. раствор) и дистиллированной воды — до объема 3 мл.
Затем во все пробирки вносили по 1 мл свежеприготовленного раствора ацетилацетона в 1 н. Na2COe и после перемешивания содержимого их плотно закрывали пробками и пометали в водяную баню, погружая в воду только до уровня содержимого.
Ацетилирование проводили при температуре 89—92° С в течение 45 мин. Более низкая температура, как указывает Бос, приводит к неполному ацетилированию; более высокая — снижает специфичность реакции.
По истечении 45 мин пробирки охлаждали в проточной водопроводной воде. В каждую приливали 3 мл этилового спирта, 1 мл реактива Эрлиха и еще 3 мл этилового спирта. Каждый раз перемешивали содержимое пробирок и. следующее добавление делали не раньше, чем через 5 мин после предыдущего.
После внесения реактива Эрлиха в течение 40—60 мин интенсивно выделяются пузырьки углекислого газа. Для ускорения выделения углекислого газа пропускали воздух через капиллярную трубку, погруженную в испытуемый раствор. Окраска развивается довольно быстро, и она очень устойчива. Колориметрировали по сравнению с контрольным на колориметре ФЭК-М с зеленым светофильтром в кювете толщиной 2 см.
Определения проводили при концентрации гексозаминов от 10 до 30 мкг в 1 мл.
Суммарное определение гексозаминов в мясе практически не дает точного представления об их содержании в соединительной ткани мяса, так как часть их связана с белками плазмы. Эта часть может быть удалена экстракцией 0,6 M раствором KCl.
Мак Интош установила, что остающиеся в строме гексозамины полностью принадлежат мукопротеинам соединительной ткани и могут служить индексом содержания этой большой и важной группы веществ соединительной ткани.
Вычисляя разницу между общим количеством гексозаминов мяса и их содержанием в фракции плазменных белков (в солерастворимой фракции), мы получили возможность не только оценить количество мукопротеинов внутримышечной соединительной ткани, но и убедиться в одновременном изменении лабильности этого компонента. Последняя определяется по его растворимости в щелочи (исследование «щелочерастворимой фракции»).
Точность в большинстве случаев составляет ±10,0% от найденной величины.
- Определение развариваемости коллагена
- Методы исследования фибриллярных компонентов внутримышечной соединительной ткани
- Фракционирование как способ оценки лабильности соединительной ткани мяса
- Количественное определение N-концевых групп в белках фракции миозина
- Определение легкогидролизуемого фосфора АТФ методом ее осаждения солями ртути
- Определение активности актомиозина по Баленовичу и Штраубу
- Определение содержания азота белков, экстрагируемых солевым раствором
- Определение растворимости белков фракции миозина
- Определение перевариваемости in vitro белков мяса ферментами при последовательном воздействии пепсина и панкреатина
- Количественное определение свободных аминокислот мясного экстракта при помощи хроматографии на бумаге
- Определение количества трудноизвлекаемого («связанного») гликогена
- Определение общего количества гликогена по Пфлюгеру в модификации Вильштеттера
- Трилонометрический метод определения содержания в мясе кальция
- Определение содержания в мясе свободной и связанной воды по методу Грау и Гамма
- Сравнительная характеристика объективных методов определения жесткости мяса
- Интенсификация процесса улучшения консистенции при созревании быстроохлажденного говяжьего мяса путем его обработки препаратом протеолитического фермента фицина
- Технология применения протеолитических ферментов для размягчения мяса при производстве натуральных полуфабрикатов
- Фицин, его свойства и методы получения
- Изменения компонентов внутримышечной соединительной ткани
- Изменения мышечных белков
- Изменения нежности и гидратации мяса
- Изменения микроскопической картины строения тканей мяса
- Общие сведения о применении протеолитических ферментов для улучшения качества мяса
- Механизм протеолиза для улучшения консистенции мяса
- Обработка ультразвуком для повышения нежности мяса
- Ускорение расслабления окоченения путем введения минеральных добавок
- Ускоренное созревание мяса при повышенной температуре с применением антибиотиков
- Ускорение созревания мяса при повышенной температуре с применением УФЛ
- Методы, основанные на ускорении развития послеубойного окоченения
- Демотация убойного скота