Изменения компонентов внутримышечной соединительной ткани
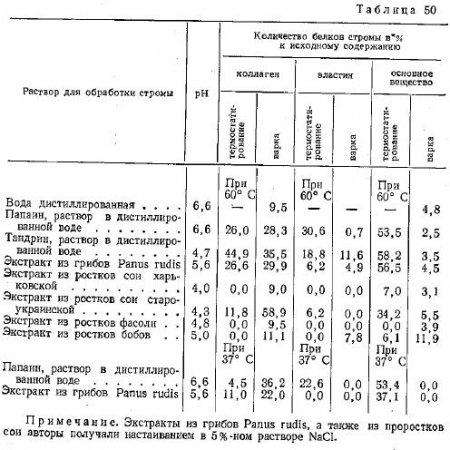
Выделяя строму полуперепончатой мышцы крупного рогатого скота, Лобанов и Елманов исследовали на ее образцах действие некоторых протеолитических ферментов. Некоторые результаты этого исследования приводятся в табл. 50. В ней указано количество белков стромы, расщепленных под действием ферментов и последующей варки,
Данные свидетельствуют о том, что ряд испытанных препаратов оказывает несомненное действие на компоненты внутримышечной соединительной ткани, в результате чего понижается гидротермическая устойчивость коллагена.
Снижение гидротермической устойчивости коллагена авторы объясняют, с одной стороны, расщеплением протеолитическими ферментами значительной части (до 58%) основного вещества, с другой — большим или меньшим ослаблением структуры коллагена, остающегося нерасщепленным. При этом различия в гидротермической устойчивости коллагена, наблюдаемые в образцах стромы с одинаковой степенью расщепления основного вещества, они объясняют действием второго фактора.
Авторы не приводят подробной методики получения стромы, а неспецифический тест для определения основного вещества дает основание усомниться в том, не содержит ли эта строма значительного количества белков актомиозинового комплекса. Это обстоятельство затрудняет интерпретацию полученных ими результатов в части, касающейся воздействия ферментов на основное вещество.
Недавно опубликовано исследование Эль-Гарбави и Уайтейкера о влиянии ряда факторов на степень переваривания ферментами белков растворимых в щелочи, эластина и коллагена двуглавой мышцы бедра крупного рогатого скота, высушенной методом сублимации.
Изучалось влияние таких факторов: pH, концентрация ферментов и наличие активаторов, а также температуры. Было найдено, что оптимальный pH для воздействия ферментов близок к нейтральному; оптимальная температура переваривания белков фицином и бромелином лежит около 80° С. Отмечена высокая активность фицина при воздействии на эластин и активирующее действие цистеина и поваренной соли при переваривании коллагена и эластина. Авторы считают, что для проявления активности фицина и бромелина в отношении коллагена необходимым условием является его денатурация.
Мак Интош и Карлин опубликовали результаты предварительных исследований действия папаина на белки полусухожильной говяжьей мышцы, применив для оценки результатов действия фермента метод ультрафильтрации. Они сделали заключение о том, что все фракции белков скелетной мышцы, взятые для исследования, подвергаются в той или иной степени воздействию папаина. Папаин действует на мукопротеин и коллаген сильнее, чем на другие белки скелетной мышцы. Данные о снижении вязкости мукопротеиновой фракции, а также об образовании гелеобразной структуры в суспензии коллагена под влиянием папаина приводят авторов к мысли о зависимости, по крайней мере частичной, размягчающегося действия папаина от расщепления соединительной ткани. Однако авторы не исключают того, что методом ультрафильтрации не могут быть обнаружены тонкие структурные изменения в белках, в том числе во внутриклеточных плазменных и структурных белках мышцы, которые могут оказывать решающее влияние на нежность мяса.
Было установлено, что при варке обработанного ферментами мяса коллаген в большей степени переходит в глютин, чем коллаген контрольных образцов (рис. 66).
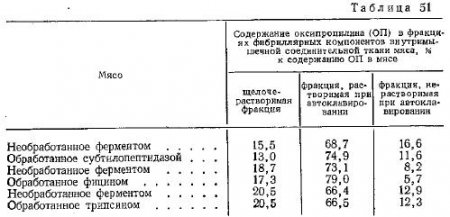
Приведенные данные свидетельствуют об увеличении развариваемости коллагена при применении для обработки мяса всех испытанных препаратов протеолитических ферментов. Однако наиболее резко выраженные изменения развариваемости коллагена наблюдаются в результате обработки мяса фицином. Достоверность разницы между значениями развариваемости коллагена для обработанного и необработанного фицином мяса очень высока. Для других ферментов полученные значения развариваемости коллагена различаются для обработанного и контрольного образцов мяса с меньшей достоверностью. Нами получены приведенные в табл. 51 и на рис. 67 данные сравнительного анализа изменений лабильности фибриллярных компонентов внутримышечной соединительной ткани мяса двухсуточного хранения, подвергавшегося и не подвергавшегося ферментированию.
Орехович, Павлихина и Шпикитер, исследуя щелочерастворимую фракцию коллагена, установили, что она идентична проколлагену, который в большей степени подвержен действию ферментов, чем коллаген. Однако наши данные об отсутствии оксипролина в солерастворимой фракции белков внутримышечной соединительной ткани свидетельствуют о том, что применявшиеся ферменты не расщепляли коллагена до осколков, которые могли быть растворены при солевой экстракции, или же они не содержали оксипролина.
При естественном ходе созревания мяса извлечение фибриллярных белков в щелочной экстракт имеет тенденцию к увеличению по мере углубления созревания. В то же время определение оксипролина в этой фракции из мяса, обработанного тремя различными протеолитическими ферментами (табл. 51), по средним данным, практически не дало никакой разницы по сравнению с необработанным мясом того же срока хранения. Больше того, в ряде случаев даже наблюдалось небольшое его уменьшение.
Опыты с применением субтилопептидазы и фицина показали, что под влиянием этих ферментов растворение фибриллярных белков соединительной ткани при автоклавировании несколько увеличивается, т. е. они становятся более лабильными. В результате воздействия трипсина увеличения лабильности этой фракции практически не наблюдалось.
Остаток, не растворенный в принятых условиях автоклавирования, уменьшается, когда применяют два первых фермента (табл. 51). Это подтверждает действенность препаратов по отношению к структурным белкам внутримышечной соединительной ткани. Как и в предыдущем случае при применении трипсина, содержание ОП в этом остатке для необработанного и обработанного ферментом мяса было почти одинаковым.
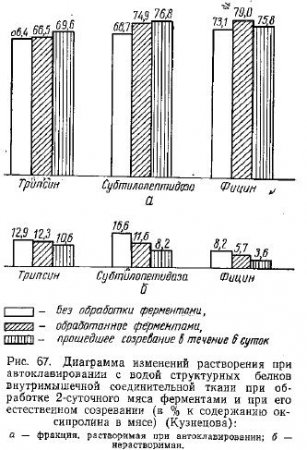
На диаграммах рис. 67 мы попытались сопоставить изменения, происходящие в структурных белках внутримышечной соединительной ткани, в ходе естественного созревания мяса при хранении в течение 6 суток при 8—10°C и в результате обработки препаратами протеолитических ферментов.
Характеристика хранившегося в течение 2 суток мяса приводится для сравнения величины изменений при созревании и ферментации с .исходными данными.
Как видно из этих диаграмм, при обработке мяса трипсином фибриллярные компоненты значительно не изменяются и состояние мяса по лабильности фракций растворимой и нерастворимой при автоклавировании остатка после щелочной экстракции не достигает уровня, отмеченного для созревшего мяса.
После обработки субтилопептидазой состояние мяса, характеризуемое содержанием оксипролина в этих фракциях, приближается к состоянию созревшего мяса, хотя и не достигает его.
Растворимость при автоклавировании коллагена из ферментированного фицином мяса больше, чем из созревшего мяса, т. е. интенсивность изменений в процессе ферментирования с фицином превышает ту, которая имеет место в ходе естественного созревания в течение 6 суток хранения мяса при 8—10°С. Тем не менее величина остатка после автоклавирования в созревшем мясе меньше, чем в ферментированном фицином, как и в случае применения других препаратов протеолитических ферментов. Таким образом, наибольшее действие на фибриллярные компоненты внутримышечной соединительной ткани обнаружено у фицина, наименьшее — у трипсина.
Выводы о преимуществах фицина по сравнению с трипсином и субтилопептидазой находятся в соответствии с литературными данными о способности препаратов протеолитических ферментов из тропических растений воздействовать на коллаген и эластин.
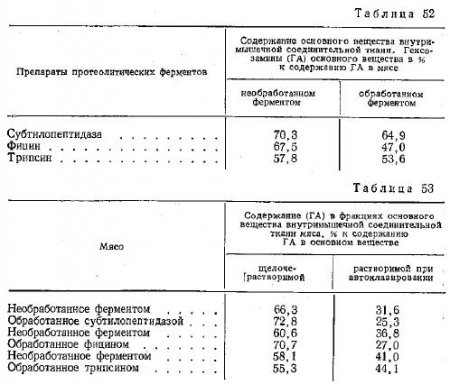
В табл. 52, 53 приведены результаты выполненных экспериментов об изменениях количества и лабильности основного вещества внутримышечной соединительной ткани при воздействии на мясо препаратов различных протеолитических ферментов.
При обработке мяса ферментами почти во всех исследованных случаях наблюдались изменения основного вещества, выражающиеся в уменьшении его количества во внутримышечной соединительной ткани. Особенно значительно это уменьшение в результате действия фицина. Однако и другие ферменты действенны по отношению к этому компоненту внутримышечной соединительной ткани.
По данным таблицы 53 можно проследить, как влияют на состояние основного вещества внутримышечной соединительной ткани различные ферменты. Так, после обработки трипсином количество легкорастворимой (растворимой в щелочи) фракции основного вещества практически не изменилось, хотя общее его содержание уменьшилось. При действии субтилопептидазы количество этой фракции основного вещества возросло с одновременным уменьшением общего количества. Особенно заметно увеличилось растворение основного вещества в щелочи под влиянием фицина, который оказал наибольшее действие и на снижение общего количества основного вещества во внутримышечной соединительной ткани мяса.
Зеркальное отображение указанных изменений можно проследить по данным, полученным в результате анализа труднорастворимой (растворимой при автоклавировании) фракции основного вещества.
Необходимо при этом отметить, что изменения нежности, измеренные по сопротивлению резания вдоль волокон сырого и вареного мяса, при обработке фицином коррелируются с изменениями развариваемости коллагена. Последняя в свою очередь связана с изменениями лабильности основного вещества.
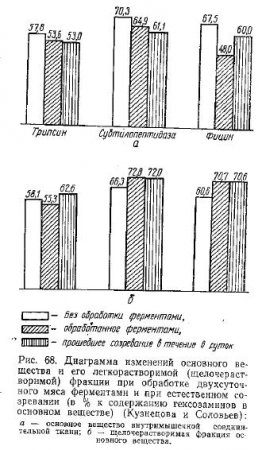
На диаграммах рис. 68 мы попытались сопоставить изменения основного вещества внутримышечной соединительной ткани под воздействием протеолитических ферментов с теми, которые происходят в результате естественного созревания мяса в течение 6 суток его хранения при 8—10°C.
Как видно из этих диаграмм, при обработке трипсином достигается такое же содержание основного вещества в мясе, как и при естественном созревании в течение 6 суток. Однако созревшее при низких положительных температурах мясо содержит более лабильные гексозаминсодержащие компоненты.
Под воздействием субтилопептидазы, напротив, не достигается уровня созревшего мяса по содержанию основного вещества, но оно становится таким же лабильным, как в созревшем в течение 6 суток.
Обработка фицином приводит к значительному, даже против созревшего мяса, уменьшению содержания основного вещества внутримышечной соединительной ткани и к одновременному увеличению его лабильности. Она практически достигает того же уровня, который отмечается в созревшем и течение 6 суток мясе.
Итак, опытами установлено, что при обработке мяса протеолитическими ферментами наблюдается уменьшение содержания в мясе основного вещества, а также увеличение его лабильности.
Из числа испытанных ферментных препаратов наиболее сильное действие на основное вещество оказывает фицин. При воздействии на мясо фицина, т. е. протеолитического фермента, вызывающего значительное увеличение нежности мяса, биохимические изменения основного вещества внутримышечной соединительной ткани происходят по той же схеме, как и во второй стадии созревания мяса.
Изменения компонентов внутримышечной соединительной ткани мяса наименее выражены при употреблении в качестве размягчителя трипсина «Дифко». Отчетливая разница выявлена только в содержании общего количества основного вещества в обработанном и контрольном образцах мяса.
Субтилопептидаза по результатам действия на внутримышечную соединительную ткань мяса занимает некоторое промежуточное положение: мясо, обработанное этим препаратом, приближается по лабильности компонентов внутримышечной соединительной ткани к состоянию созревшего, но отличается от него более высоким содержанием основного вещества. То же наблюдается и в отношении фибриллярных компонентов и развариваемости коллагена.
Проведенные биохимические исследования, подкрепленные микроскопическими и органолептическими наблюдениями, позволяют исследованные препараты протеолитических ферментов по силе их воздействия на мясо разместить в такой последовательности:
фицин > субтилопептидаза > трипсин «Дифко»
Представленные данные дают возможность установить, что процесс обработки мяса ферментами вызывает в нем изменения, в основном однотипные с теми, которые имеют место при длительном созревании: увеличивается количество небелкового азота, наблюдается накопление в белках фракции миозина N-концевых групп одних и тех же аминокислот, возрастает развариваемость коллагена при варке мяса и автоклавировании щелоченерастворимых белков внутримышечной соединительной ткани, уменьшается содержание и увеличивается лабильность основного вещества этой же ткани.
Следствием указанных биохимических изменений в обоих случаях является увеличение гидратации и нежности мяса, а также весьма сходные изменения в микроскопической картине строения тканей мяса.
Итак, изучение механизма воздействия на мясо препаратов различных протеолитических ферментов дает дополнительное доказательство того, что процесс увеличения нежности при созревании мяса в естественных условиях представляет собой начальную стадию протеолиза.
Кроме того, установлено, что тот или другой препарат протеолитического фермента может быть с успехом использован для улучшения консистенции мяса только в том случае, если он активно воздействует не только на миофибриллярные белки, но также и на компоненты внутримышечной соединительной ткани (ее основное вещество и фибриллярные белки).
При этом результат воздействия фицина превышает влияние длительного созревания мяса на процессы накопления N-концевых групп о белках фракции миозина, увеличения гидратации мяса, увеличения лабильности фибриллярных компонентов и основного вещества внутримышечной соединительной ткани, уменьшения количества основного вещества и увеличения развариваемости коллагена.
Примененный при исследовании метод фракционирования компонентов внутримышечной соединительной ткани позволил обнаружить участие этих компонентов как в наступлении посмертных изменений при окоченении мяса, так и в деструктивных процессах, приводящих к размягчению консистенции мяса в процессе его созревания. Фракционирование дает возможность вскрыть характер изменений, протекающих во внутримышечной соединительной ткани в процессе естественного созревания при низких положительных температурах и при обработке мяса протеолитическими ферментами. Весьма близкое сходство наблюдаемых изменений, а также значительное ускорение деструктивных процессов за счет применения протеолитических ферментов позволяют сделать выводы о больших перспективах использования ферментов в целях интенсификации процесса улучшения консистенции мяса при его созревании.
Результаты, полученные за рубежом, относятся к действию ферментных препаратов, выработанных фирмами. Их нельзя механически переносить на соответствующие им препараты отечественного производства, так как, безусловно, имеются различия как в характеристике сырья, так и в деталях технологии производства препаратов, а следовательно, в их активности.
Поэтому при разработке приемов и режимов новой прогрессивной технологии созревания мяса с применением протеолитических ферментов необходима детальная проверка их действия на мясо, его важнейшие компоненты, и в том числе на соединительную ткань.
В России препараты протеолитических ферментов, предназначенные для размягчения мяса, в промышленном масштабе еще не вырабатываются.
Рассматривая наиболее вероятные источники сырья для получения препаратов протеолитических ферментов, следует иметь в виду, что в России ограниченное количество дынного дерева разводится на некоторых опытных участках в Закавказье; на этих деревьях плоды окончательно не созревают. Кроме того, на зональной опытной станции Всесоюзного института лекарственных и ароматических растений (ВИЛАР) в Кобулети выращивается перуанская папайя дуболистая (carica quercifolia), из которой можно получать папаин, не уступающий ферменту, применяемому в США и Западной Европе.
Более перспективным для России растительным протеолитическим ферментом следует считать фицин, получаемый из инжира, широко распространенного на юге страны, включая Краснодарский край и Крым. Имеются также данные о возможности применения для этих целей препарата, полученного из проросших соевых бобов и грибов Panus rudis.
Для размягчения мяса в промышленных масштабах также могут быть применены ферменты животного происхождения — панкреатин, трипсин и ферментная смесь АФС. Кроме того, по доступности сырья, экономической эффективности и возможности организации изготовления ферментных препаратов в широких производственных условиях, безусловно, перспективными являются поиски ферментативных источников из числа непатогенных микроорганизмов, плесневых грибов и актиномицетов.
В каждом отдельном случае выбору того или иного фермента в качестве размягчителя мяса должно предшествовать углубленное изучение его действия и сравнение с другими ферментами.
He исключена возможность создания комплексного препарата, включающего в себя все или некоторые из указанных ферментов. Литературные данные на этот счет противоречивы. Так, Бавизотто, Миллер и Дьюэн изучали вопрос о совместимости протеаз растительного, животного и микробного происхождения. Они исследовали изменения активности в парных сочетаниях фицина, папаина, бромелина, розимов А-4 и П-11, протеазы 15, трипсина и пепсина. Во всех опытах, контролируемых по перевариванию гемоглобина и желатина, был отмечен антагонистический эффект различных протеолитических ферментов. Антагонистическое действие было особенно заметным при смешивании протеиназ из грибов с другими ферментами. Авторы предполагают, что антагонизм заключается во взаимном переваривании и присутствии в субстратах ингибиторов.
С другой стороны, Андеркафлер, основываясь на исследованиях Американского мясного института, заявил, что при размягчении мяса смеси растительных, грибных и бактериальных протеиназ обладают несомненными преимуществами по сравнению с любым отдельным ферментом.
Вопрос о возможности применения комплексных препаратов для размягчения мяса должен быть исследован дополнительно.
В делом необходимо констатировать, что применение протеолитических ферментов в промышленных масштабах для улучшения консистенции мяса дает значительный экономический эффект, повышает качество и усвояемость мяса и будет способствовать развитию производства мясных полуфабрикатов.
- Изменения мышечных белков
- Изменения нежности и гидратации мяса
- Изменения микроскопической картины строения тканей мяса
- Общие сведения о применении протеолитических ферментов для улучшения качества мяса
- Механизм протеолиза для улучшения консистенции мяса
- Обработка ультразвуком для повышения нежности мяса
- Ускорение расслабления окоченения путем введения минеральных добавок
- Ускоренное созревание мяса при повышенной температуре с применением антибиотиков
- Ускорение созревания мяса при повышенной температуре с применением УФЛ
- Методы, основанные на ускорении развития послеубойного окоченения
- Демотация убойного скота
- Адренализация убойного скота
- Изменения питательной ценности мяса в процессе созревания
- Изменения летучих редуцирующих веществ в процессе созревания мяса
- Перераспределение пуринового азота по фракциям
- Изменения нежности в процессе созревания мяса различных видов животных
- Гипотезы о сущности процесса улучшения консистенции мяса при его созревании
- Динамика показателей, характеризующих состояние белковых компонентов внутримышечной соединительной ткани
- Динамика показателей, характеризующих состояние миофибриллярных белков
- Динамика показателей, характеризующих состояние саркоплазматических белков
- Изменения в белковой системе мяса в целом
- Физико-химические изменения в процессе созревания мяса
- Микробиологические изменения в процессе созревания мяса
- Органолептические изменения при созревании мяса
- Автолиз мышечной ткани в асептических условиях
- Тепловое окоченение и окоченение при оттаивании
- Особенности окоченения в различных мускулах и в мышечной ткани разных видов животных
- Изменения гидратации мышц
- Образование актомиозинового комплекса
- Распад АТФ и креатинфосфата