Количественное определение N-концевых групп в белках фракции миозина
Применив метод определения содержания N-концевых групп, Локшина и Орехович изучали течение процесса ферментативного гидролиза таких белков, как яичный и сывороточный альбумин, проколлаген и стурин пепсином, трипсином и химотрипсином. Авторы пришли к выводу, что при увеличении продолжительности процесса протеолиза в белковом субстрате появляются новые свободные N-концевые группы различных аминокислот. Следовательно, метод определения N-концевых групп можно с успехом применять для изучения процесса протеолиза в тех случаях, когда обычные методы (определение различных форм азота) по тем или другим причинам не могут дать ответа на поставленные вопросы.
Бейли расширил область применения этого метода, использовав его для изучения строения миозина, тропомиозина и фибриногена.
При изучении выделенных из миозина растворимых в эфире ДНФ производных аминокислот Бейли пришел к заключению, что этот белок в нативном состоянии практически не имеет свободных N-концевых групп аминокислот, входящих в данную фракцию. Следовательно, нативный миозин так же, как и тропомиозин, построен из циклических пептидных цепей.
Бейли применил метод определения N-концевых групп также для изучения стабильности пептидных связей указанных белков в кислой и щелочной средах. При этом автором было установлено, что хранение раствора миозина при pH 13 приводит к расщеплению пептидных связей, которое распознается по образованию в миозине свободных N-концевых групп треонина, серина и дикарбоновых кислот. Позже Саад и Коминц установили, что глютаминовая кислота, серин и аланин образуют N-концевые группы денатурированного тропомиозина, причем первая из них содержится в наибольших количествах.
Эти данные указывают на неустойчивость циклического строения пептидных цепей в миозине. Такое строение может быть нарушено при воздействии тех или иных факторов.
Поскольку основной структурный белок, обусловливающий консистенцию мышечной ткани - миозин, мы решили проверить, не происходит ли в процессе созревания при воздействии протеиназ мяса расщепление циклических пептидных цепей белков фракции миозина с образованием свободных N-концевых групп аминокислот. Поскольку дериваты большинства аминокислот (за исключением трех) экстрагируются эфиром, ограничились исследованием только эфирной фракции.
Для определения содержания N-концевых групп в белках фракции миозина был использован метод Caнгepa в модификации Троицкой.
Локкером была предпринята аналогичная попытка, которая не привела к положительным результатам. Поэтому мы внесли в применявшуюся Локкером методику ряд уточнений.
Концевые остатки белков отличаются от других групп в пептидной цени тем, что они содержат свободные H2 и COOH группы, и этот факт используется для их количественного определения.
Динитрофениловый метод основан на следующих реакциях:
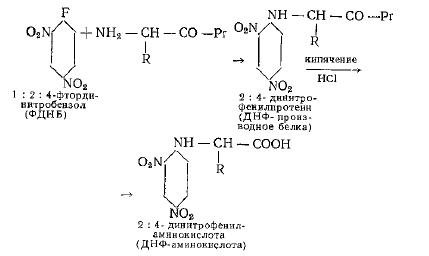
Исследуемый белок обрабатывают спиртовым раствором динитрофторбензола при слабощелочной реакции; причем этим реагентом связывают только имеющиеся в белковой молекуле свободные аминогруппы, а аминогруппы, находящиеся в белке в виде пептидов, остаются незатронутыми.
Выпадающий при этом в осадок динитрофенилпротеин подвергают солянокислотному гидролизу. Во время гидролиза динитрофенилированного белка N-кокцевые остатки освобождают в виде ДНФ-производных аминокислот, окрашенных в желтый цвет. При этом в гидролизате наряду с ДНФ-аминокислотами образуются свободные аминокислоты. ДНФ-производные аминокислот затем экстрагируются эфиром, их большинство переходит при этом в эфирную вытяжку, а часть (аргинин, s-лизин и гистидин) остается в кислотно-водной вытяжке и в свою очередь экстрагируется бутанолом. Эфирный и водный экстракты фракционируются каждый в отдельности путем разделительной 2-мерной хроматографии на бумаге. Водная фракция нами не исследовалась. После элюирования полученных при хроматографировании эфирной фракции пятен может быть определена оптическая плотность растворов для установления количественного содержания той или другой концевой аминокислоты в испытуемом белке.
Выделяли белки фракции миозина из мяса по модифицированному методу Любимовой.
Из работы Любимовой известно, что при выделении миозина экстракцией солевыми растворами с последующим осаждением белка десятикратным разведением водой, кроме миозина и актомиозина, также осаждаются креатинфосфофераза, миокиназа и дезаминаза адениловой кислоты. Причем дезаминаза AK относительно прочно связана с белком, а другие ферменты без особого труда отмываются от мышечной кашицы водой и в очищенных таким путем препаратах миозина их найти невозможно.
При разработке методики мы также руководствовались данными Сент-Дьердьи о том, что при кратковременной (10-минутной) экстракции из мышечной ткани извлекаются миозин, а при длительной — актомиозин. Следовательно, для того чтобы избежать в ходе определения при воздействии солевых растворов образования актомиозинового комплекса (что будет маскировать истинное состояние белков в мясе), необходимо производить кратковременную экстракцию миозина.
При этих условиях препараты белка будут содержать лишь незначительные количества актомиозина, образованного в ходе определения.
Исходя из указанных условий, в методику выделения миозина нами были внесены соответствующие изменения. От полученного на холоде фарша отбирают навеску в 250 г, помещают в измельчитель и заливают 500 мл охлажденного 0,6 M раствора NaCl.
После 2—3 мин измельчения смесь помещают в центрифужные стаканы и настаивают при охлаждении в течение 10 мин с перемешиванием. Затем жидкость отделяют от осадка на рефрижераторной центрифуге в течение 10—15 мин при 3000 об/мин. Жидкость сливают декантацией через вату в мерный стакан, помещенный в лед. Осадок в центрифужных стаканах еще раз обрабатывают 0,6 M раствором KaCl без настаивания при соотношении 1:2 к первоначальному весу мяса с перемешиванием стеклянной лопаточкой и центрифугированием. После центрифугирования жидкость вновь сливают через воронку с ватой и присоединяют к первоначальному экстракту. Количество полученного таким путем экстракта замеряют, разбавляют в 4—5 раз охлажденной дистиллированной водой, затем добавляют 1 объем ацетатного буфера, имеющего pH 5,2 (равный замеренному объему экстракта), и разбавляют в 110—20 раз (по отношению к замеренному количеству экстракта) охлажденной дистиллированной водой.
При отстое на холоде в течение 2—4 ч выпавший осадок белков фракции миозина оседает. В случае плохого осаждения и получения мутного раствора над осадком, указывающего на неполноту осаждения, необходимо проверить pH раствора и довести его до нужной величины (5,2) очень осторожным Добавлением разбавленной уксусной кислоты или слабого раствора NaOH, можно также дополнительно разбавить водой в 1,5—2 раза.
Жидкость над осадком по возможности сливают сифоном, а остаток центрифугируют с охлаждением и 4-кратной промывкой небольшим количеством охлажденной дистиллированной воды. Затем растворяют миозин в 300- 400 мл 0,6 M раствора NaCl с подщелачиванием 0,1—0,5 н. NaOH до pH 8—9. Hepacтворившуюся часть белка отделяют центрифугированием, раствор белков фракции миозина фильтруют через вату. Объем замеряют и белок вновь осаждают путем 10—20-кратного разведения охлажденной водой в присутствии ацетатного буфера. Для достижения полноты осаждения смесь помешают на ночь в холодильник. На другой день жидкость над осадком сливается сифоном, а осадок белков фракции миозина отделяют центрифугированием и растворяют в 80—100 мл охлажденного раствора Вебера, имеющего pH 9,1. При этом проверяется pH и доводится до 9,0 слабым раствором NaOH. После 10—15 мин растворения полученный раствор центрифугируют и фильтруют через вату.
Для получения ДНФ-производных белков фракции миозина к 150—180 г раствора белков фракции миозина (взятого по весу) добавляют двойной объем спиртового раствора динитрофторбензола (0,2 г ДНФБ растворяют в указанном количестве спирта) и смесь взбалтывают на холоде стеклянной мешалкой в течение 2 ч, поддерживая pH 8 периодическим добавлением 0,1 н. NaOH.
Затем раствор подкисляют 0,1 н. HCl до pH 6—6,5 и охлаждают 1 ч в холодильнике. Окрашенный в желтый цвет осадок ДНФ-производных белков фракции миозина отделяют на рефрижераторной центрифуге, промывают для удаления свободного динитрофенола три раза с центрифугированием небольшими порциями охлажденного спирта, имеющего pH 6,5—7,0. Осадок осторожно стеклянной лопаточкой переносят на взвешенный и высушенный стеклянный фильтр l-g-2 и перемешивают на фильтре со свободным от перекисей безводным эфиром. Оставшийся в центрифужном стакане осадок переносят на фильтр небольшим количеством спирта, добавляя при этом прямо на фильтр эфир и перемешивая осадок стеклянной палочкой.
Колбу, в которую вставлен стеклянный фильтр, присоединяют к водоструйному насосу. Осадок на фильтре промывают несколько раз эфиром с перемешиванием стеклянной палочкой, пока промывная жидкость не станет бесцветной.
Оставшийся на стеклянной палочке незначительный осадок снимают скальпелем и присоединяют к осадку на фильтре.
Осадок на фильтре высушивают в эксикаторе над CaCl2 до постоянного веса.
При динитрофенилировании и гидролизе белка образуются окрашенные в желтый цвет побочные продукты — динитрофенол и динитроанилин, которые переходят при экстракции в эфирную фракцию. Динитроанилин на одномерной хроматограмме располагается близ линии фронта растворителя и не мешает определению. Динитрофенол располагается в центре хроматограммы и может накладываться на пятна ДНФ-аминокислот. С целью счистки от динитрофенола, мы применяли метод сублимации (возгонки под вакуумом) в специальном приборе, предложенном Милльсом.
Для проведения гидролиза, на аналитических весах взвешивают около 1,0 г ДНФ-производного миозина и навеску помещают в гидролизную пробирку. Туда же добавляют 25—35 мл 6 н. соляной кислоты. Осадок тщательно растирают с кислотой стеклянной лопаточкой, лопаточку обмывают небольшим количеством 6н. соляной кислоты. К пробирке присоединяют пришлифованный лабораторный стеклянный воздушный холодильник и ставят на кипящую баню (глицерин + вода в соотношении 1:3) для гидролиза при 105° С в течение 8 ч.
Содержимое пробирок во время гидролиза периодически перемешивают взбалтыванием, а при наличии больших комочков растирают стеклянной лопаточкой, обмывая ее каждый раз небольшим количеством 6 н. соляной кислоты.
После окончания гидролиза лабораторные воздушные холодильники промывают небольшим количеством дистиллированной воды. Гидролизат количественно переносят через фильтровальную бумагу в высокую экстракционную пробирку с притертой пробкой емкостью 160—180 мм (при разбавлении водой в 2 раза по отношению к первоначальному объему).
К профильтрованному и разбавленному гидролизату добавляют 30—40 мл очищенного от перекисей и обезвоженного серного эфира.
Пробирку закрывают притертой стеклянной пробкой, энергично встряхивают, ее содержимое отстаивается и эфирный слой отсасывается водоструйным насосом в круглодонную колбу.
Экстракцию эфиром повторяют 4—5 раз, собирая эфирную фракцию в ту же колбу. После каждой экстракции эфир из круглодонной колбы частично отгоняют на водяной бане при температуре не выше 50° С до объема в 10—15 мл. Затем эфирный экстракт переносят в маленькую делительную воронку, колбу ополаскивают несколько раз небольшими порциями эфира и эфирный экстракт промывают 3 раза небольшими порциями (по 3 мл) 1 н. соляной кислоты, стараясь сливать каждый раз водную фазу полностью без потерь эфирного слоя. Для очистки ДНФ-производных аминокислот от примеси динитрофенола эфирный экстракт из делительной воронки переносят в колбу прибора для сублимации. Там ДНФ-аминокислоты путем отгонки эфира на водяной бане, имеющей температуру не выше 50° С, распределяют тонким равномерным слоем по стенкам колбы. После этого к колбе присоединяют насадку с притертым шлифом и пробиркой, доходящей почти до дня колбы, для охлаждающей смеси (смесь этилового спирта с сухим льдом). Прибор присоединяют к масляному насосу, и динитрофенол сублимируется в течение 3 мин на водяной бане при 70° С. После этого осадок растворяется в 5—10 мл эфира и распределяется тонким слоем по стенкам колбы путем испарения эфира и снова подвергается сублимации в течение 3 мин.
После окончания сублимации осадок ДНФ-производных аминокислот с помощью эфира смывают со стенок на дно колбы, эфир испаряется на водяной бане, а осадок растворяют в небольшом количестве ацетона и количественно переносят пипеткой на хроматографическую бумагу.
ДНФ-производные аминокислот окрашены в желтый цвет и не требуют дополнительного проявления на хроматограммах. Весь ацетоновый раствор ДНФ-производных аминокислот переносят на листы медленно впитывающей бумаги для хроматографии (28х60 см) медицинской (или тонкой пастеровской) пипеткой на 0,1—0,2 мл. На каждый лист наносят пятно от одной пробы. После нанесения пятен ДНФ-производные аминокислот переводят в аммиачные соли протягиванием листов бумаги (по месту нанесения на них пятен) в парах аммиака. Затем производят хроматографическое разделение ДНФ-производных методом нисходящей двухмерной хроматографии.
В качестве первого растворителя берется бутанол, насыщенный 0,1%-ным водным аммиаком. Нижняя (водная) фаза растворителя служит для насыщения хроматографической камеры, а верхнюю фазу растворителя заливают в лодочку.
Подготовленные вышеуказанным способом листы бумаги помещают для насыщения на 1/2 ч в камеру, на дне которой установлены сосуды с водной фазой, затем в лодочку заливают 60—80 мл верхней фазы растворителя.
Разделение протекает в зависимости от температуры окружающего воздуха от 14 до 36 ч в затемненной камере, затем хроматограммы -высушивают при 40° С до удаления растворителя. После этого от листа отрезают часть хроматограммы с пятном ДНФ-дикарбоновых аминокислот, а остальную хроматограмму помещают в другую камеру. В лодочку заливают 0,72М фосфатный буфер, имеющий pH 6,0. На дне камеры размещен поддон с водой. Разделение во втором направлении продолжается 2—4 ч, затем хроматограмму высушивают при 40° С в течение 30 мин и визуально оценивают пятна ДНФ-аминокислот в ультрафиолетовом свете.
Идентификация выделенных ДНФ-аминокислот нами проводилась: а) регенерацией в присутствии аммиака с последующим хроматографическим разделением образовавшихся свободных аминокислот по их свидетелям (по описанному выше методу Боде и Гири), б) установлением места расположения пятна ДНФ-производного данной аминокислоты на двухмерной хроматограмме (по описанному выше методу) в присутствии свидетеля и в) установлением величины Rf.
Для регенерации ДНФ-производных аминокислот эфирную фракцию, полученную при экстракции этих кислот из смеси после гидролиза соляной кислотой, трехкратно промывали небольшими порциями воды. Затем эфир удаляли, а сухой остаток подвергали гидролизу 25%-ным аммиаком в запаянных ампулах или в пробирках с лабораторным обратным холодильником при температуре 105° С в течение 6 ч.
После гидролиза аммиак удаляли выпариванием досуха. Сухой остаток растворяли з 2 н. HCl. Продукты распада ДНФ-производных удаляли экстракцией эфиром, а аминокислоты исследовали хроматографически нингидриновым методом.
Препараты ДНФ-производных свободных аминокислот необходимы в качестве свидетелей для идентификации отдельных пятен на хроматограммах, а также для построения калибровочных кривых при количественном определении.
Основные положения методов получения ДНФ-производных аминокислот даны в работах Абдергальдена, а также Сангера, Браунитцера, Милльса.
0,2 г тонкоизмельченной аминокислоты смешивают с 0,4 г NaHCO3 и 5—10 мл воды, нагревают при 40° С в течение 10 мин в колбе, имеющей пришлифованный воздушный холодильник, на водяной бане до растворения.
После этого к раствору добавляют 0,2 г ФДНБ, растворенного в двойном (по отношению к пробе) объеме этилового спирта. Колбу обертывают черной бумагой и пористой резиной и устанавливают в шюттель-аппарат. Смесь встряхивают в течение 2 ч (если применяют глютаминовую и аспарагиновую кислоты, реакция с ФДНБ проходит медленно, встряхивать необходимо 4—5 ч). Выпавший желтый осадок оставляют в холодильнике на ночь.
На другой день колбу с содержимым нагревают на водяной бане, при этом осадок растворяется. Если часть осадка остается, то его отфильтровывают в горячем состоянии. Фильтр и колбу промывают спиртом, а осадок удаляют.
Фильтрат переносят в фарфоровую чашку и выпаривают на водяной бане досуха для удаления спирта. Когда полученная масса охладится, ее заливают холодной водой и оставляют растворяться без перемешивания.
Затем раствор фильтруют через складчатый фильтр и фильтрат экстрагируется эфиром для удаления избытка ФДНБ. После этого добавляют NaOH и производят вторичную экстракцию эфиром для удаления динитроанилина (ДНА).
К отдельной пробе фильтрата добавляют разбавленную 1 н. HCl до выпадения фракции маслянистой консистенции.
В основную массу нагретого фильтрата вносят небольшой избыток HCl и оставляют на ночь для образования маслянистого осадка.
Раствор над осадком отсасывают вакуум-насосом через стеклянный фильтр № 4 и осадок промывают холодной водой (вода добавляется в очень малых количествах во избежание его растворения).
Осадок на фильтре растворяют в эфире и переносят в колбу прибора для сублимации, в которой очищают ДНФ-производное аминокислоты от примесей динитрофенола.
Эфир выпаривают, а осадок распределяют тонким слоем по стенкам колбы. Сублимируют динитрофенол под вакуумом на водяной бане при 70° С в течение 3 мин.
После окончания первой сублимации проводят повторное растворение осадка в эфире и повторную сублимацию при тех же условиях.
Очищенный сублимацией препарат ДНФ-аминохислоты в теплом состоянии растворяют в небольшом количестве (1—2 мл) ледяной уксусной кислоты. Уксуснокислый раствор при умеренном нагревании разбавляют водой до начала помутнения. Затем появившуюся муть слабым нагреванием растворяют и прозрачный раствор оставляют стоять 1—4 дня на холоде для кристаллизации.
Выделившиеся кристаллы отсасывают через стеклянный фильтр, промывают уксусной кислотой и водой (или отпрессовывают на глине и высушивают под вакуумом в парах кипящего ацетона или толуола) и проводят перекристаллизацию из соответствующих растворителей.
При изготовлении препаратов ДНФ-производных дикарбоновых кислот вместо уксусной кислоты осадок растворяют в небольшом количестве метилового спирта и добавляют воду до выпадения осадка (спирт-вода 1:10). Через 2—3 дня кристаллизации в холодильнике осадок отсасывают с применением вакуума и промывают водой.
В случае приготовления препарата лейцина, после выделения кристаллов из уксусной кислоты переосаждение проводят из смеси спирта с водой (спирта немного, воды в несколько раз больше). Кристаллизация длится несколько дней в холодильнике. Кристаллы отсасывают масляным насосом и промывают ледяной водой. Полученные ДНФ-производные аминокислот высушивают в эксикаторе над СаСl2 до постоянного веса. Чистоту препаратов проверяют, устанавливая их температуру плавления и гомогенность при хроматографировании. Кроме того, определяют местоположение их пятен на хроматограммах и величину Rf.
Таким методом нами были приготовлены препараты ДНФ-производных аспарагиновой и глютаминовой кислот, аланина, лейцина, серина. ДНФ-производные серина и глютаминовой кислоты получены для качественных определений — идентификации этих производных по Rf их пятен.
Изготовленные препараты ДНФ-производных аминокислот имели следующую температуру плавления: аспарагиновая кислота — 186° С(180—187°), аланин — 178° С (178°, 178°), лейцин — 130° С (94—95°). В скобках дается температура плавления указанных препаратов по литературным данным.
При получении ДНФ-производного лейцина по вышеописанной методике лейцин и изолейцин не разделяются; они находятся в смеси, чем и объясняется расхождение.
Все ДНФ-производные аминокислот (за исключением ДНФ-производных пролина и оксипролина) дают характерный максимум поглощения в ультрафиолетовой части спектра при длине волны 360 ммк, ДНФ-пролин и ДНФ-оксипролин — при 385 ммк. Поэтому определяют оптическую плотность испытуемых спиртовых растворов ДНФ-производных аминокислот при 360 ммк.
Предварительно готовят растворы полученных препаратов индивидуальных ДНФ-производных (свидетелей) различных аминокислот и для каждого ДНФ-производного строят калибровочную кривую зависимости оптической плотности от концентрации.
На основании полученных показаний величины оптической плотности при какой-либо известной концентрации ДНФ-производного данной аминокислоты вычисляют, как описано выше, величину коэффициента R.
Для количественной оценки разделенных хроматографическим путем ДНФ-производных аминокислот, составляющих N-концевые группы испытуемых белков фракции миозина, пятна на бумаге очерчивают в УФ-свете, вырезают и измельчают ножницами.
Затем вещество элюируют из бумаги 1%-ным раствором NaHCO3 при 60° С на водяной бане в течение 20 мин и раствор охлаждают до комнатной температуры. В зависимости от интенсивности окраски пятен берут от 4 до 15 мл элюирующего раствора.
Контрольным раствором при измерении служит элюат со свободного от пятен участка хроматограммы (приблизительно равного по площади среднему размеру пятна).
Оптическая плотность полученных таким путем растворов замеряется на спектрофотометре и количество ммоль аминокислоты на 1 моль миозина рассчитывают по формуле
D = Ev*1000*MB1*a/RCMB2*1000000,
где D - количество ммолей аминокислоты на 1 моль миозина;
E — оптическая плотность;
v — объем элюата, мл;
1000 — пересчет на ммоль данной ДНФ-аминокислоты;
MB1 — расчет на 1 моль миозина (MB1 = 850000);
а — пересчет на ммоли данной аминокислоты;
R — постоянный коэффициент для данной ДНФ-аминокислоты;
С — навеска желтого осадка, г;
MB2 — молекулярный вес ДНФ-производного данной аминокислоты;
1000000 — пересчет количества ДНФ-производного аминокислоты, выраженного в мкг, на грамм.
Расхождения между параллельными пробами составляли от 4 до 10% от найденной величины.
Таким образом, по сравнению с применявшейся Локкером методикой, кроме самого метода хроматографического разделения, нами были внесены следующие изменения.
Объектом нашего исследования был значительно более однородный по своему составу белковый материал. Локкер экстрагировал мясо вебер-эдсалевским раствором, мы же выделяли из мяса белки фракции миозина по методу Любимовой двойным их переосаждением путем разбавления водой солевых экстрактов при тщательной промывке осадков.
При выделении исследуемых белков из солевых экстрактов мы, как отмечено выше, не применяли рекомендуемое Локкером осаждение спиртом, так как эта операция вызывает их денатурацию, которая приводит к образованию в их молекулах N-концевых групп ряда аминокислот.
Для повышения точности метода увеличили навеску исходного материала в 20 раз.
Локкер проводил гидролиз ДНФ-протеинов в присутствии соляной кислоты в течение 16—20 ч. Мы уменьшили продолжительность этой операции до 8 ч. Это было вызвано тем, что, как показали проведенные нами предварительные опыты, увеличение продолжительности гидролиза с 8 до 12 ч приводит к разрушению части ДНФ-производных аминокислот, что снижает процент их обнаружения.
- Определение легкогидролизуемого фосфора АТФ методом ее осаждения солями ртути
- Определение активности актомиозина по Баленовичу и Штраубу
- Определение содержания азота белков, экстрагируемых солевым раствором
- Определение растворимости белков фракции миозина
- Определение перевариваемости in vitro белков мяса ферментами при последовательном воздействии пепсина и панкреатина
- Количественное определение свободных аминокислот мясного экстракта при помощи хроматографии на бумаге
- Определение количества трудноизвлекаемого («связанного») гликогена
- Определение общего количества гликогена по Пфлюгеру в модификации Вильштеттера
- Трилонометрический метод определения содержания в мясе кальция
- Определение содержания в мясе свободной и связанной воды по методу Грау и Гамма
- Сравнительная характеристика объективных методов определения жесткости мяса
- Интенсификация процесса улучшения консистенции при созревании быстроохлажденного говяжьего мяса путем его обработки препаратом протеолитического фермента фицина
- Технология применения протеолитических ферментов для размягчения мяса при производстве натуральных полуфабрикатов
- Фицин, его свойства и методы получения
- Изменения компонентов внутримышечной соединительной ткани
- Изменения мышечных белков
- Изменения нежности и гидратации мяса
- Изменения микроскопической картины строения тканей мяса
- Общие сведения о применении протеолитических ферментов для улучшения качества мяса
- Механизм протеолиза для улучшения консистенции мяса
- Обработка ультразвуком для повышения нежности мяса
- Ускорение расслабления окоченения путем введения минеральных добавок
- Ускоренное созревание мяса при повышенной температуре с применением антибиотиков
- Ускорение созревания мяса при повышенной температуре с применением УФЛ
- Методы, основанные на ускорении развития послеубойного окоченения
- Демотация убойного скота
- Адренализация убойного скота
- Изменения питательной ценности мяса в процессе созревания
- Изменения летучих редуцирующих веществ в процессе созревания мяса
- Перераспределение пуринового азота по фракциям