Изменения мышечных белков
Партман пришел к выводу, что при искусственном созревании мяса расщепляются не только белки мышечных волокон, но и белки соединительной ткани.
По данным Мияды и Таппеля, бромелин, фицин и папаин расщепляют коллаген, а некоторые из них (фицин) — также и эластин.
В табл. 45, взятой из работы Тсена и Таппеля, дается сравнительная характеристика интенсивности гидролиза актомиозина некоторыми протеолитическими ферментами при 40° С в течение 1 ч.
Авторы отмечают, что папаин, активно действуя на миозиновую часть актомиозина, вместе с этим практически не переваривает актин.
Более подробно баланс азотистых веществ в процессе искусственного созревания мяса под воздействием папаина изучали Шормюллер и Адлер. Они исследовали мышечную ткань, предварительно, перед обработкой ферментом, дважды пропущенную через мясорубку. Поэтому полученные ими результаты характеризуют лишь направление процессов и не могут служить показателями глубины изменений, происходящих в неповрежденной мышечной ткани при воздействии протеолитических ферментов.
Авторы отмечают, что уже в самом начале опыта в экстракте появляются свободные аминокислоты, состав которых в дальнейшем не изменяется, а лишь увеличивается их содержание.
Больше всего содержится в экстракте гликоколла и аланина, меньше всего — аспарагиновой кислоты; появления свободного пролина не наблюдалось.
При изучении изменений аминокислот, связанных в виде пептидов, авторы пришли к выводу, что при искусственном созревании белок преимущественно расщепляется на высокомолекулярные частицы.
Нами сравнивались между собой по интенсивности процесса образования небелкового азота (табл. 46) три препарата различных протеолитических ферментов, вводившихся в мясо в одинаковых по активности количествах (3,8 ед/мл). Для сопоставления приведены результаты определений небелкового азота в мясе в процессе его естественного созревания при 8—10° С между вторыми и шестыми сутками хранения.
Результаты свидетельствуют о том, что по интенсивности накопления в мясе неосаждаемых трихлоруксусной кислотой продуктов распада белков на первом месте стоит субтилопептидаза, на втором — трипсин и только на третьем месте фицин. Во всех трех случаях оцениваемая по данному показателю интенсивность процесса протеолиза значительно выше, чем при созревании мяса в естественных условиях.
При сравнении этих данных с приведенными на рис. 64 результатами определения интенсивности размягчения мышечной ткани в аналогичных условиях и этими же ферментными препаратами необходимо констатировать, что интенсивность протеолитического воздействия данных ферментов на белки мяса, оцениваемая по накоплению небелкового азота, не совпадает с интенсивностью процесса размягчения мышечной ткани. Во втором случае указанные препараты располагаются по степени убывающей активности в противоположном порядке: фицин, трипсин, субтилопептидаза.
Из этого нами был сделан вывод: улучшение нежности мяса при его обработке протеолитическими ферментами нельзя охарактеризовать одним таким показателем, как накопление небелкового азота.
Весьма интересно проследить, как поддается мясо ферментированное и неферментированное воздействию протеолитических ферментов желудочно-кишечного тракта. Для решения этого вопроса нами были поставлены опыты по изучению перевариваемости in vitro полусухожилыных мышц крупного рогатого скота при последовательном воздействии на них пепсином и панкреатином.
В опытные образцы мяса шприцеванием вводился раствор фицина, в контрольные образцы, взятые от той же туши, — прокипяченный раствор фицина.
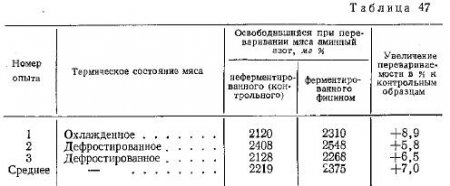
По истечении срока ферментирования те и другие образцы варили в одинаковых условиях, измельчали и затем в них определяли количество освобожденного аминоазота при последовательном воздействии пепсина и панкреатина. Результаты опытов представлены в табл. 47.
Данные табл. 47 показывают, что мясо, подвергнутое предварительной обработке раствором фицина, легче поддается последующему воздействию на него ферментов желудочно-кишечного тракта. Белки предварительно ферментированного мяса оказываются в какой-то мере уже подготовленными и легче расщепляются пепсином и панкреатином с освобождением аминоазота. Таким образом, перевариваемость in vitro ферментированного мяса в среднем на 7,0% выше, чем неферментированного. Это указывает на важность процесса ферментироваяия для улучшения не только органолептических, но и физиологических свойств мяса.
Приведенные результаты согласуются с данными Фарелля о том, что обработка мяса протеолитическими ферментами увеличивает его перевариваемость более чем на 16%.
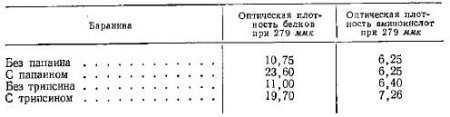
Цендер и сотрудники обрабатывали мясо препаратами папаина и трипсина. Они показали, что действие указанных ферментов на мясо начинается с освобождения растворимых в глицине белков, и на первой стадии действие папаина не сопровождается увеличением количества свободных аминокислот. Однако при действии трипсина одновременно с увеличением количества растворимых белков наблюдается некоторое увеличение количества свободных аминокислот.
Ниже приведены изменения в белковой системе бараньего мяса при воздействии на него протеолитических ферментов (по данным Цендера и сотрудников):
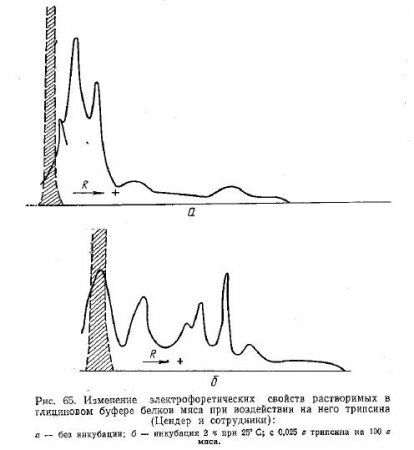
Электрофоретическим разделением белков мяса, переходящих в глициновый экстракт, установлено, что при воздействии трипсина образуются новые белковоподобные составные части мышечной ткани (рис. 65).
Они характеризуются более высокой электрофоретической подвижностью. Как предполагают авторы, эти составные части являются продуктами первичной деструкции миофибриллярных белков.
На основании полученных данных авторы выдвигают предположение, что действие ферментативных размягчителей мяса заключается в ограниченном переваривании фибриллярных или, возможно, соединительнотканых белков мяса. Поэтому мы решили более глубоко изучить этот вопрос и сравнить по содержанию N-концевых групп белки фракции миозина, выделенные из мяса двухсуточного хранения до и после его обработки препаратами протеолитических ферментов (трипсином и фицином). В опытах с трипсином объектом исследования служила полусухожильная мышца, а с фицином — длиннейшая мышца спины. В первом случае активность испытуемого препарата составляла 3,8 ед/мл (по методу водно-спиртового титрования). В опытах с фицином была принята оптимальная концентрация фермента для проведения процесса ферментирования мяса в производственных условиях (2,0—2,5 ед/мл).
В табл. 48 приведены данные о накоплении N-концевых аминокислот в белках фракции миозина, выделенных из мяса до и после его обработки трипсином. Для сравнения в ней указано содержание N-концевых аминокислот в белках фракции миозина парного необработанного трипсином мяса.
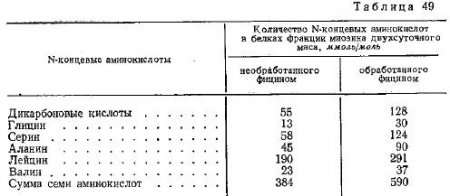
Таблица 49 включает в себя данные о накоплении N-концевых групп в белках фракции миозина в результате обработки мяса фицином.
Вследствие различий в методике постановки опытов мы, к сожалению, не можем дать количественного сравнения действия фицина и трипсина на белки фракции миозина. Однако необходимо отметить, что при обработке мяса препаратами этих протеолитических ферментов, так же как и в процессе его естественного созревания, в белках фракции миозина всегда накапливаются концевые группы одних и тех же аминокислот. Это указывает на однотипность процессов.
Кроме концевых групп лейцина и дикарбоновых кислот, при действии трипсина также образуются значительные количества остатков глицина, а при действии фицина — N-концевых групп серина.
Необходимо также обратить внимание на такой факт: при воздействии на мясо фицина в концентрациях, которые мы рекомендуем для применения в производственных условиях, суммарное количество шести N-концевых аминокислот в белках фракции миозина превышает величину этого показателя для созревшего мяса шестисуточного хранения при 8—10° С (соответственно 553 и 433 ммоль на 1 моль миозина).
- Изменения нежности и гидратации мяса
- Изменения микроскопической картины строения тканей мяса
- Общие сведения о применении протеолитических ферментов для улучшения качества мяса
- Механизм протеолиза для улучшения консистенции мяса
- Обработка ультразвуком для повышения нежности мяса
- Ускорение расслабления окоченения путем введения минеральных добавок
- Ускоренное созревание мяса при повышенной температуре с применением антибиотиков
- Ускорение созревания мяса при повышенной температуре с применением УФЛ
- Методы, основанные на ускорении развития послеубойного окоченения
- Демотация убойного скота
- Адренализация убойного скота
- Изменения питательной ценности мяса в процессе созревания
- Изменения летучих редуцирующих веществ в процессе созревания мяса
- Перераспределение пуринового азота по фракциям
- Изменения нежности в процессе созревания мяса различных видов животных
- Гипотезы о сущности процесса улучшения консистенции мяса при его созревании
- Динамика показателей, характеризующих состояние белковых компонентов внутримышечной соединительной ткани
- Динамика показателей, характеризующих состояние миофибриллярных белков
- Динамика показателей, характеризующих состояние саркоплазматических белков
- Изменения в белковой системе мяса в целом
- Физико-химические изменения в процессе созревания мяса
- Микробиологические изменения в процессе созревания мяса
- Органолептические изменения при созревании мяса
- Автолиз мышечной ткани в асептических условиях
- Тепловое окоченение и окоченение при оттаивании
- Особенности окоченения в различных мускулах и в мышечной ткани разных видов животных
- Изменения гидратации мышц
- Образование актомиозинового комплекса
- Распад АТФ и креатинфосфата
- Увеличение содержания ионов кальция в экстракте и инактивирование фактора Марша-Бендолла