Механизм протеолиза для улучшения консистенции мяса
По Браунштейну в образовании и превращениях ферментсубстратных соединений имеются следующие стадии:
а) присоединение молекул субстрата к ферменту;
б) преобразование первичного промежуточного соединения в один или несколько последовательных (переходных) комплексов;
в) отделение конечных продуктов реакции в течение одной или несколько стадий.
При некоторых ферментативных реакциях встречаются промежуточные комплексы, в которые входит не вся молекула субстрата, а та или иная ее часть.
В образовании фермент-субстратных комплексов могут участвовать в различных сочетаниях, кроме ковалентных, координационных и ионных связей, также и менее прочные формы связей между молекулой фермента и отдельными группами молекулы субстрата (водородные связи, электростатическое притяжение полярных групп и др.).
Закономерности субстратной специфичности привели многих авторов к мысли о множественном сродстве фермента к молекуле субстрата. В образовании этих промежуточных соединений участвует не одна функциональная группа фермента, а несколько таких групп, вступающих во взаимодействие с соответствующими группами молекулы субстрата. Ho лишь одна или немногие пары взаимодействующих групп принимают участие в катализируемой данным ферментом реакции. Остальные связи служат для прикрепления в определенном порядке молекулы субстрата к ферменту. Вместе с тем эти дополнительные связи могут оказывать существенное влияние на эффективность каталитической реакции, специфически повышая реакционную способность промежуточного комплекса.
Следовательно, активный центр фермента состоит из ряда ориентированных определенным образом функциональных групп. Среди них различают одну или несколько, каталитически активных групп (реактивный участок активного центра фермента) и группы, образующие участок, обеспечивающий связывание субстрата с ферментом (контактирующий участок).
Как отмечает автор, это разделение в известной мере условно.
Соединения, имеющие пространственную или электронную конфигурацию, сходную с конфигурацией молекулы субстрата или ее частей, проявляют сродство к контактирующему участку фермента и, оттесняя от него субстрат, действуют в качестве конкурентных ингибиторов. Реагенты же, взаимодействующие с каталитически активными группами, вызывают неконкурентное и необратимое блокирование фермента. Следует также иметь в виду, что функциональные группы, из которых состоит активный центр, не занимают смежного положения в пептидных цепях белковой молекулы фермента, а находятся в разных отрезках этих цепей, сближенных друг с другом во вторичной или третичной белковой структуре фермента. Для протеолитических ферментов в качестве функциональных групп активных центров имеют важное значение сульфгидрильная группа цистеина, гидроксильная группа серина и имидазольная группа гистидина. Для действия химотрипсина и трипсина доказано совместное участие двух последних групп. По мнению многих исследователей, такие протеиназы, как химотрипсин, трипсин и пепсин, имеют по одному активному центру на молекулу.
Как известно, пепсин, трипсин и химотрипсин в организме синтезируются в виде своих неактивных предшественников (пепсиноген, трипсиноген, химотрипсиноген), которые затем активируются,
В настоящее время существуют две точки зрения на этот процесс. Согласно первой активная группировка уже существует и не проявляется в проферментах, так как ее блокируют ингибиторы и процесс активации заключается в деблокировании готового активного центра.
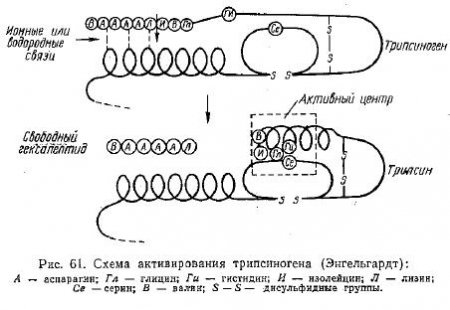
Приверженцы второй точки зрения исходят из того, что активная группировка возникает в процессе превращения профермента в фермент, связанным с образованием низкомолекулярных продуктов. Имеются основания считать, что процесс превращения трипсиногена в трипсин протекает по второму пути (рис. 61).
На этой схеме видно, каким путем образуется активный центр, благодаря которому не обладающий ферментативной активностью трипсиноген превращается в активный протеолитический фермент — трипсин.
Ранее предполагалось, что все белки перевариваются протеолитическими ферментами только в денатурированной форме, и поэтому процесс протеолиза можно выразить уравнением
N ⇔ D → фермент Р,
где N — нативный белок;
D—денатурированный белок;
P — продукты переваривания.
Действительно, глобулярные белки приобретают максимальную ферментативную гидролизуемость в истинно денатурированном состоянии, т. е. когда разрушены их вторичная и третичная структуры. В то же время эти же белки гидролизуются протеиназами и в нативном состоянии, но с меньшей скоростью. Taким образом, денатурированное состояние белка-субстрата не является непременным условием для его расщепления протеолитическими ферментами. Процесс протеолиза характерен тем, что потеря белком одной или нескольких амидных групп, разрыв одно-двух пептидных связей, взаимодействие с несколькими простейшими ионами могут вызвать весьма существенные изменения физико-химических свойств этого белка. При определенных (очень мягких) условиях эти изменения могут коснуться только какой-то небольшой части общего числа его молекул. В результате при электрофорезе может появиться новая белковая фракция. Поэтому очень незначительные изменения в строении молекулы субстрата могут превратить хороший субстрат в непригодный и даже в ингибитор фермента.
Изучению механизма протеолиза посвящено огромное число исследований, результаты которых суммированы в ряде обзорных и экспериментальных работ.
Теоретически можно представить три возможных пути протеолиза:
а) «взрывной» распад каждой отдельной белковой молекулы с образованием сразу конечных продуктов реакции. Причем даже при длительном течении реакции удается обнаружить неизмененный (неатакованный) белок, а продукты протеолиза не подвергаются дальнейшим изменениям;
б) постепенное отщепление от белковой молекулы концевых низкомолекулярных продуктов гидролиза с сохранением на первых стадиях процесса высокомолекулярного остатка, способного к дальнейшему перевариванию;
в) первоначальное расщепление белковой молекулы на крупные фрагменты, которые постепенно деградируют до конечных продуктов распада.
Первая из перечисленных гипотез была выдвинута Тизелиусом и Эрикссон-Квенсель и впоследствии был получен ряд данных, подтверждающих наличие реакций, протекающих по этому принципу.
Однако при определенных условиях, например при низкой концентрации фермента, в процессе протеолиза могут получаться довольно большие количества промежуточных продуктов с высоким молекулярным весом. Так, было найдено, что при переваривании дифтерийного антитоксина пепсином при pH 3,5—4,0 в течение 24 ч при 37° С получаются преимущественно высокомолекулярные продукты, а при оптимальных для пепсина условиях реакции среды (pH 2,0) преобладают низкомолекулярные продукты.
Локшина установила, что при действии трипсина и химотрипсина на стурин в процессе протеолиза происходит изменение состава небелковой фракции. Следовательно, образующиеся в начале реакции крупномолекулярные продукты распада белков подвергаются дальнейшему постепенному расщеплению протео-литическими ферментами и реакция протеолиза имеет ступенчатый характер.
В данном случае, как считает В.Н. Орехович, в начале реакции имеет место такое превращение белков, когда один белок под влиянием протеиназы превращается в другой с новыми свойствами и сохранением нативной формы. Образующиеся крупномолекулярные обломки затем расщепляются до низкомолекулярных пептидов. По такому пути идет расщепление миозина трипсином, γ-глобулина папаином и бромелином. Течение протеолиза нативных белков по типу превращения белков или по типу их дезинтеграции в большей степени определяется структурой белка, а не видом использованной протеиназы.
Наконец, возможен и третий механизм протеолиза, когда под действием фермента от концов белковой молекулы последовательно отщепляется по одному аминокислотному остатку. Такой путь наиболее характерен для действия пептидаз (карбоксипептидаза, лейциновая аминопептидаза), в некоторых случаях он возможен и для расщепления белков, например при активировании проферментов протеиназ.
Доказано, что трипсин расщепляет в белках пептидные связи, образованные при участии карбоксильных групп аргинина и лизина. При этом пептидные связи лизина с аспарагиновой и глютаминовой кислотами, имеющими свободную α-карбоксильную группу, трипсином не расщепляются. Ho когда α-карбоксильная группа блокирована, эти связи легко расщепляются. Химотрипсин расщепляет преимущественно пептидные связи, образованные с участием карбоксильных групп тирозина, фенилаланина, метионина и отчасти триптофана. Эта специфичность зависит также от природы белкового субстрата. Например, в рибонуклеазе химотрипсин гидролизует связи, образованные при участии карбоксильных групп лейцина, аспарагина и гистидина. Коллагеназа расщепляет пептидные связи, образованные аминными группами глицина и карбоксильными группами оксипролина, а также аланина и пролина. Эластаза, кроме эластина, гидролизует и другие белки: гемоглобин, фибрин, альбумин, казеин, а также денатурированный нагреванием коллаген.
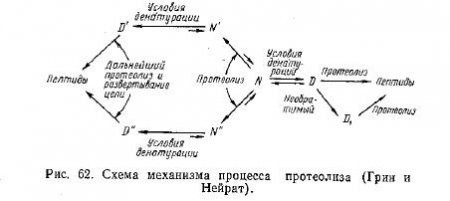
Суммируя все имеющиеся в литературе экспериментальные данные о механизме ферментативного расщепления белков, Грин и Нейрат предложили следующую, наиболее вероятную и всеобъемлющую теорию протеолиза. Нативный белок имеет на своей поверхности относительно мало пептидных связей, причем лишь немногие из них способны гидролизоваться данным ферментом. Относительные скорости протеолиза нативной и денатурированной форм белка зависят от ряда факторов, в частности от относительных концентраций нативной и денатурированной форм, а также от относительного числа в каждой форме связей, способных гидролизоваться. Гидролиз внутренних пептидных связей полипептидных цепей вызывает нарушение цепочечной структуры белка без обязательного освобождения пептидных фрагментов. Эту стадию процесса можно рассматривать как ограниченный протеолиз. Течение процесса протеолиза по тому или другому пути зависит от специфичности и концентрации фермента, структуры субстрата, присутствия денатурирующих агентов, pH, температуры и других факторов.
Авторы предложили схему протеолиза (рис. 62), которая дает возможность объяснить большинство имеющихся экспериментальных данных.
- Обработка ультразвуком для повышения нежности мяса
- Ускорение расслабления окоченения путем введения минеральных добавок
- Ускоренное созревание мяса при повышенной температуре с применением антибиотиков
- Ускорение созревания мяса при повышенной температуре с применением УФЛ
- Методы, основанные на ускорении развития послеубойного окоченения
- Демотация убойного скота
- Адренализация убойного скота
- Изменения питательной ценности мяса в процессе созревания
- Изменения летучих редуцирующих веществ в процессе созревания мяса
- Перераспределение пуринового азота по фракциям
- Изменения нежности в процессе созревания мяса различных видов животных
- Гипотезы о сущности процесса улучшения консистенции мяса при его созревании
- Динамика показателей, характеризующих состояние белковых компонентов внутримышечной соединительной ткани
- Динамика показателей, характеризующих состояние миофибриллярных белков
- Динамика показателей, характеризующих состояние саркоплазматических белков
- Изменения в белковой системе мяса в целом
- Физико-химические изменения в процессе созревания мяса
- Микробиологические изменения в процессе созревания мяса
- Органолептические изменения при созревании мяса
- Автолиз мышечной ткани в асептических условиях
- Тепловое окоченение и окоченение при оттаивании
- Особенности окоченения в различных мускулах и в мышечной ткани разных видов животных
- Изменения гидратации мышц
- Образование актомиозинового комплекса
- Распад АТФ и креатинфосфата
- Увеличение содержания ионов кальция в экстракте и инактивирование фактора Марша-Бендолла
- Амилолитический путь распада гликолена
- Гликолитические процессы после прекращения жизни животного
- Биохимические процессы в мясе животного после убоя
- Физические изменения мышц животного после убоя