Изменения микроскопической картины строения тканей мяса
Эти изменения сопровождаются набуханием мышечных волокон.
При изучении ферментативного воздействия на коллагеновую соединительную ткань Ванг с сотрудниками отмечал типичную последовательность ее изменений под воздействием фицина, бромелина и папаина: освобождение основного вещества; уменьшение способности к окрашиванию соединительной ткани; полная потеря способности к окрашиванию; потеря фибриллярного характера структурных элементов соединительной ткани и их превращение в аморфный материал.
Было показано, что ферментные препараты, полученные из тропических растений и поджелудочной железы, обладают коллагеназной активностью и действуют, таким образом, на оба структурных элемента мяса: мышечную и соединительную ткань. Применявшиеся микробные ферменты не имели коллагеназной активности или она была незначительна. Отмечено, что ХТ-протеолитический фермент, гидролаза Д, гидролаза ТП и амилаза из плесневых грибов в основном действуют на мышечные волокна и ограниченно на основное вещество соединительной ткани без повреждения структуры коллагеновых волокон.
Результаты погружения перемизиальной соединительной ткани в четырехпроцентные растворы трех ферментов из тропических растений показали, что волокна, обработанные бромелином и фицином, почти достигают последней стадии коллагенолиза.
Суммарное Действие фермента и последующей варки было значительно сильнее, чем каждого из них в отдельности.
Ферментативное действие на эластин начиналось с сегментации индивидуальных волокон. Размер сегментационного процесса увеличивался во времени, вплоть до полной дезинтеграции волокон. Наибольшей эластолитической активностью обладал фицин, затем папаин и, наконец, бромелин. Бактериальные и грибные ферменты не проявляли такой активности, тогда как панкреатические препараты — коммерческий трипсин и виоказа — в некоторой степени расщепляли эластин.
Подкрепив полученные результаты исследований данными дегустационной оценки бифштексов, приготовленных из ферментированной и контрольной полусухожильной мышцы, Ванг и другие пришли к выводу: увеличение нежности мяса при обработке протеолитическими ферментами увязывается главным образом с дезинтеграцией сарколеммы и оболочек мышечных волокон и с уменьшением растяжимости последних.
Кроме того, большая концентрация фермента необходима для размягчения бифштексов из полусухожильной мышцы, чем из длиннейшей мышцы спины.
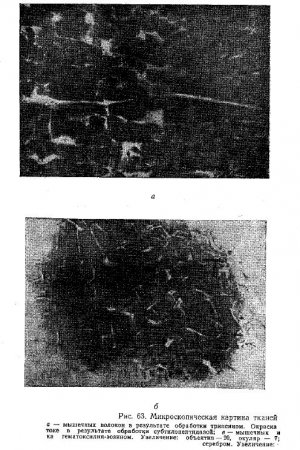
На рис. 63 приведены результаты наблюдений В.А. Адуцкевича о структурных изменениях в мышечной и соединительной тканях, вызываемых действием на мясо препаратов различных протеолитических ферментов. Через 3 ч после обработки мяса трипсином «Дифко» происходит резко выраженное набухание, разрыхление и частый сегментный распад мышечных волокон на первичные саркомеры с сохранением сарколеммы и слабовыраженной исчерченности волокон и с зернистым распадом ядер (см. рис. 63, а).
При этом не наблюдались значительные изменения в соединительной ткани мяса, обработанного трипсином. После обработки мяса субтилопептидазой (рис. 63, б) микроскопическая картина мышечных и соединительнотканых волокон мало отличается от описанной. Набухание волокон в этом случае выражено более интенсивно, чем после применения трипсина «Дифко», и наблюдается сплошное деление волокон на первичные саркомеры.
После обработки мяса фицином (рис. 63, в и г) также происходит резко выраженное набухание, разрыхление, частый сегментный распад мышечных волокон на первичные саркомеры с частичным разрушением сарколеммы (рис. 63, г) и зернистый распад сегментов на вторичные — конечные саркомеры — инокоммы и пылевидный распад ядер.
Кроме того, наблюдается исчезновение исчерченности и конфигурации, характеризующей сокращенное состояние мышечных волокон. Изменения в межмышечной соединительной ткани характеризуются ее разрыхлением, отделением и распадом (рис. 63, в и е). При обработке мяса фицином микроскопические изменения более резко выражены, чем в процессе созревания мяса после шести дней хранения туши при температуре 8—10° С. Сопоставление указанных наблюдений о микроскопических изменениях, возникающих в мясе в результате его обработки препаратами протеолитических ферментов, с рассмотренными нами ранее данными об изменениях при созревании мяса свидетельствует о весьма близком сходстве микроскопической картины мяса в этих двух случаях.
Различия заключаются в том. что при воздействии протеолитических ферментов:
а) поперечная и продольная исчерченность становится слабо различимой;
б) распад волокна на строго разграниченные сегменты не так отчетливо выражен, как при созревании в естественных условиях. Фермент, проникая внутрь волокна, интенсивно воздействует на всю его массу, а действие катепсинов носит избирав тельный характер (по-видимому, в связи с определенной локализацией).
Кроме того, воздействие фицина выражается в частичном нарушении в отдельных местах целостности сарколеммы (рис. 63, г, верхнее волокно).
- Общие сведения о применении протеолитических ферментов для улучшения качества мяса
- Механизм протеолиза для улучшения консистенции мяса
- Обработка ультразвуком для повышения нежности мяса
- Ускорение расслабления окоченения путем введения минеральных добавок
- Ускоренное созревание мяса при повышенной температуре с применением антибиотиков
- Ускорение созревания мяса при повышенной температуре с применением УФЛ
- Методы, основанные на ускорении развития послеубойного окоченения
- Демотация убойного скота
- Адренализация убойного скота
- Изменения питательной ценности мяса в процессе созревания
- Изменения летучих редуцирующих веществ в процессе созревания мяса
- Перераспределение пуринового азота по фракциям
- Изменения нежности в процессе созревания мяса различных видов животных
- Гипотезы о сущности процесса улучшения консистенции мяса при его созревании
- Динамика показателей, характеризующих состояние белковых компонентов внутримышечной соединительной ткани
- Динамика показателей, характеризующих состояние миофибриллярных белков
- Динамика показателей, характеризующих состояние саркоплазматических белков
- Изменения в белковой системе мяса в целом
- Физико-химические изменения в процессе созревания мяса
- Микробиологические изменения в процессе созревания мяса
- Органолептические изменения при созревании мяса
- Автолиз мышечной ткани в асептических условиях
- Тепловое окоченение и окоченение при оттаивании
- Особенности окоченения в различных мускулах и в мышечной ткани разных видов животных
- Изменения гидратации мышц
- Образование актомиозинового комплекса
- Распад АТФ и креатинфосфата
- Увеличение содержания ионов кальция в экстракте и инактивирование фактора Марша-Бендолла
- Амилолитический путь распада гликолена
- Гликолитические процессы после прекращения жизни животного