Активная реакция среды
Приготовление буферных смесей
Буферные смеси состоят преимущественно из растворов слабых кислот и их щелочных солей. Они поддерживают постоянный pH, связывая известное количество ионов H+ и ОН-, образующихся в процессе реакции или специально добавленных. Активная реакция среды в буферных растворах при этом резко не меняется, хотя соотношение в концентрации веществ, входящих в состав буферной смеси, несколько сдвигается. Применение буферных смесей позволяет проводить работы при определенном pH.
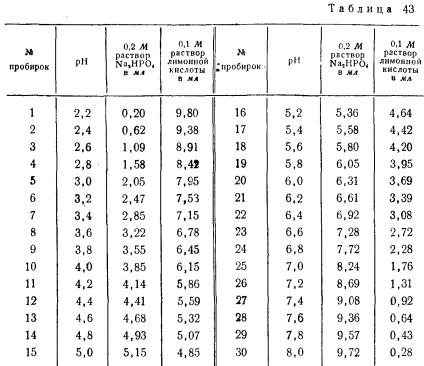
Одной из употребительных буферных смесей является лимонно-фосфатная.
Лимонно-фосфатная буферная смесь
Приготовление растворов
а) 0,2 M раствор Na2HPО4 готовят из очищенного препарата соли. Продажную соль Na2HPO4 * 12H2O растворяют при нагревании в 1,3 части воды; раствор фильтруют и охлаждают при помешивании. Осадок отсасывают и высушивают при 36—38° в течение нескольких дней, контролируя содержание кристаллизационной воды прокаливанием пробы. Препарат точно соответствует формуле дигидрата, когда потеря веса при прокаливании составляет 25,28+0,1%. Для приготовления 1 л 0,2М раствора требуется 35,603 г Na2HPO4 * 2Н2О.
б) Для приготовления раствора лимонной кислоты пригодна лимонная кислота квалификации ч.д.а. На 1 л 0,1 M раствора требуется 21,008 г лимонной кислоты.
Буферные смеси готовят смешением в пробирках буферных растворов в соотношениях, указанных в табл. 43.
Колориметрические методы определения pH
Колориметрические методы определения pH основаны на том, что при изменении концентрации ионов водорода в растворе изменяется окраска индикатора. Таким образом, о величине pH раствора судят по окраске индикатора.
Ориентировочное определение pH исследуемого раствора универсальным индикатором
В практической работе и лабораторных исследованиях часто требуется определить pH ориентировочно. Для этого пользуются универсальным индикатором, окраска которого изменяется в большом интервале pH, например от 4 до 10,5. Окраска обычных индикаторов изменяется в очень небольшом пределе pH (1,5—2,0). Способность универсального индикатора изменять окраску в большом интервале pH обусловлена тем, что он представляет собой смесь нескольких индикаторов. Ниже приведен состав одного из универсальных индикаторов.

Пользуясь бумажной цветной шкалой (рис. 42), можно определить pH, сравнивая окраску исследуемого раствора после его смешения с индикатором. 2—3 мл раствора, помещенного в фарфоровую чашечку, смешивают с двумя-тремя каплями универсального индикатора; подбирают одинаковую окраску на цветной шкале.
Определение pH буферным методом
Определив pH исследуемого раствора универсальным индикатором, приступают к более точному определению pH. Для этого приготовляют серию буферных растворов с интервалом pH 0,2. Если, например, при предварительном определении получился pH 6,5, то готовят шкалу с интервалом pH от 6,0 до 7,0. Пробирки, применяемые для приготовления буферной шкалы, должны быть из бесцветного стекла, одинакового диаметра и хорошо промыты и высушены.
После смешения буферных растворов в каждую пробирку добавляют одинаковое число капель индикатора. Индикатор выбирают, пользуясь табл. 44.
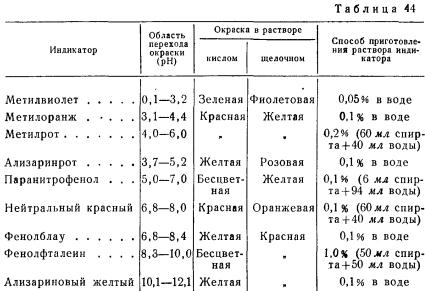
Пользуясь буферной шкалой, можно определить pH раствора. Для этого к 10 мл исследуемого раствора добавляют такое же количество капель индикатора.
pH исследуемого раствора устанавливают колориметрическим сравнением стандартного раствора с испытуемым.
Безбуферный метод определения pH
Для колориметрического определения pH пользуются прибором Михаэлиса, состоящим из ряда пробирок с различно окрашенными растворами. Этот ряд может быть также приготовлен самими учащимися.
Для шкалы Михаэлиса применяют следующие индикаторы

Чтобы приготовить стандартные растворы, в сухие пробирки из бесцветного стекла одинакового диаметра градуированной пипеткой вносят указанные в табл. 44 количества миллилитров растворов индикатора. В каждую пробирку добавляют недостающее до 7 мл количество 0,1 N раствора углекислой соды, встряхивают и закрывают пробками. Если эталоны предназначают для длительного пользования, то пробирки запаивают.
В табл. 45 приводится безбуферный ряд Михаэлиса.
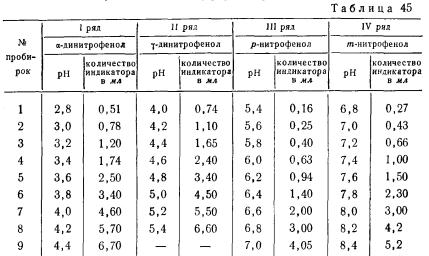
Ряд Михаэлиса рассчитан на определение pH от 2,8 до 8,4. При работе с этим рядом на 6 мл исследуемого раствора необходимо брать 1 мл индикатора.
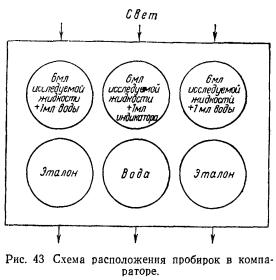
Удобнее сравнивать окраску растворов при помощи компаратора. В среднее гнездо помещают пробирку с исследуемым раствором, а в два боковых — пробирки со стандартными растворами. Если определяют pH в мутных или окрашенных растворах (разбавленное молоко, сыворотка крови, яичный белок, слюна и т. д.), то пользуются вторым рядом гнезд, с тем чтобы получить однородный фон при сравнении. Для этого в две пробирки наливают исследуемую жидкость, разбавленную водой в соотношении 6 : 1, и помещают их в компаратор позади пробирок со стандартными растворами. В одно из средних гнезд ставят пробирку с водой, в другое — пробирку с испытуемым раствором и индикатором.
Схема расположения пробирок в компараторе показана на рис. 43.
Колориметрическими методами pH определяют с точностью до 0,1.
Свойства буферных растворов
а) При разведении буферного раствора водой pH практически не меняется. Готовят буферную смесь по заранее заданному pH. В одной части смеси определяют pH, например при помощи ряда Михаэлиса, а другую часть разводят дистиллированной водой в 5—10 раз и после разведения вновь определяют pH.
Установив, что при умеренном разведении буферной смеси водой pH не меняется, делают вывод, что при работе с буферными жидкостями можно применять разбавление водой без смещения pH, что имеет большое практическое значение при определении pH в мутных и окрашенных жидкостях.
б) При добавлении к буферному раствору кислоты или щелочи pH резко не меняется. В одну пробирку наливают дистиллированную воду, в другую — буферную смесь с pH, близким к pH дистиллированной воды (pH дистиллированной воды обычно равен 6,0—6,5). В обе пробирки добавляют по две капли метилоранжа и по каплям 0,1 N раствор серной или соляной кислоты.
Устанавливают, что для изменения pH воды требуется одна капля кислоты, а для изменения pH буферной смеси — значительное количество кислоты.
- Определение содержания золы в тканях
- Определение содержания влаги в тканях
- Защитные покрытия
- Упаковки для хранения продуктов
- Влияние радиоактивных излучений на сохранность мясопродуктов
- Влияние углекислого газа на сохранность мяса и других продуктов
- Влияние ультрафиолетовых лучей на мясо и мясопродукты
- Фитонциды
- Антибиотики
- Консервирующие химические средства
- Повышение устойчивости мяса при хранении
- Повышение стойкости яиц при хранении
- Продукты переработки яиц
- Изменения яйца при хранении
- Химический состав яйца
- Химия яйца
- Сальные железы
- Потовые железы
- Использование креатина
- Химия кожного покрова и его производных
- Гормоны задней доли гипофиза
- Гормональные препараты передней доли гипофиза
- Гипофиз (мозговой придаток)
- Половые железы
- Надпочечные железы
- Поджелудочная железа
- Паращитовидные железы
- Щитовидная железа
- Железы внутренней секреции
- Мочевая кислота
