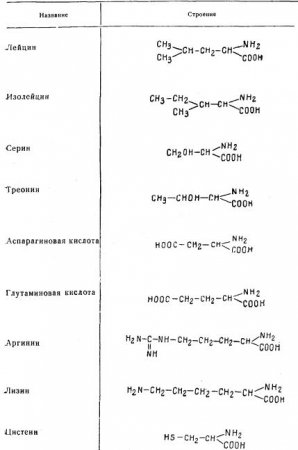
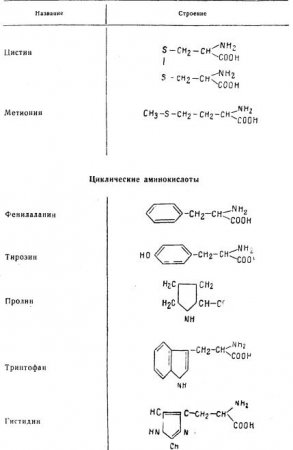
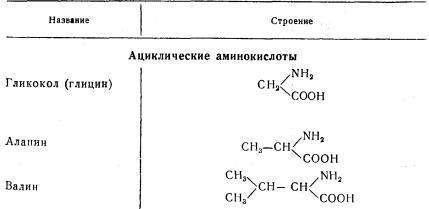
Аминокислоты
Одним из важнейших методов изучения химического состава сложных органических веществ является гидролиз, т. е. расщепление сложного вещества на более простые. Этот процесс протекает с присоединением по месту разрыва связей элементов частицы воды; отсюда его название.
Белки гидролизуются при кипячении с крепкими кислотами, щелочами, а также при воздействии ферментов. При этом они постепенно распадаются на менее сложные соединения. Конечными продуктами гидролиза белков являются аминокислоты.
Ниже приведены важнейшие аминокислоты, встречающиеся в белках.
Валин, лейцин, изолейцин, треонин, аргинин, лизин, метионин, фенилаланин, триптофан, гистидин являются незаменимыми аминокислотами. Незаменимые аминокислоты не могут синтезироваться в организме животных и должны обязательно поступать с пищей.
Отсутствие в пище хотя бы одной незаменимой аминокислоты приводит к нарушению обмена, приостановке роста и, наконец, к гибели животного. Белки, в состав которых входят все десять незаменимых аминокислот, являются полноценными, если же в белке недостает хотя бы одной незаменимой аминокислоты, то он считается неполноценным.
Аминокислоты — бесцветные кристаллические вещества, имеют небольшой молекулярный вес, хорошо растворяются в воде, за исключением тирозина и цистина.
По строению все аминокислоты, входящие в состав белков, являются α-аминокислотами, у которых аминогруппа связана с атомом углерода, соседним с карбоксильной группой, т. е. с углеродом в α-положении:
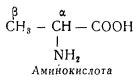
Большинство аминокислот содержит одну кислотную (карбоксильную) группу и одну основную (аминную) группу.
Подобные соединения являются амфотерными (двойственными), поэтому в водных растворах они ведут себя одновременно как кислоты и как основания (II). При изменении реакции среды в кислую сторону диссоциация карбоксильных групп подавляется и аминокислоты ведут себя как основания (I), а при изменении реакции среды в щелочную сторону подавляется диссоциация аминных групп и аминокислоты ведут себя как кислоты (III):
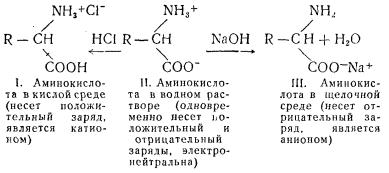
Вследствие амфотерной природы аминокислоты могут быть буферами и способствовать поддержанию постоянства активной реакции среды.
Если аминокислота содержит две аминные группы, то она будет иметь основной характер, если две карбоксильные, то кислый.
За исключением гликокола, все аминокислоты имеют асимметрический атом углерода и, являясь оптически деятельными, вращают плоскость поляризованного луча. Аминокислоты сообщают белкам свои оптические свойства.
По химической природе аминокислоты наиболее приспособлены к тому, чтобы быть структурными единицами белков. Они способны образовывать все те сочетания, которые свойственны кислотам, основаниям, солям, не являясь сами в полном смысле слова ни кислотами, ни основаниями, ни солями.
Оксигруппы, входящие в состав некоторых аминокислот, сообщают им свойства спиртов. Обилие химических видоизменений увеличивается благодаря тому, что среди аминокислот имеются диаминовые и цикарбоновые соединения, а также соединения, содержащие фосфор и серу.
- Белки
- Химия важнейших веществ, входящих в состав организма животных
- Активная реакция среды
- Значение воды для жизни организма
- Элементарный состав организмов
- Понятие об обмене веществ
- Производство зубных щеток
- Производство гребней и расчесок
- Производство костяных (бельевых) пуговиц
- Сырье для производства предметов широкого потребления
- Производство желудочного сока
- Производство инсулина-сырца
- Производство жидких препаратов
- Производство сухих препаратов
- Основные процессы в производстве органопрепаратов
- Сбор и обработка эндокринного, ферментного, специального сырья
- Производство органопрепаратов
- Производство сухого яичного порошка
- Производство меланжа
- Покрытие яиц искусственными оболочками
- Известкование яиц
- Брак яиц
- Структура, химический состав и биологические свойства яйца
- Прием и сортировка яиц
- Заготовка и транспортировка яиц
- Расчеты при переработке крови убойных животных
- Требования, предъявляемые к готовой продукции альбумина
- Производство кровяной муки
- Производство гематогена
- Производство светлого и темного пищевого альбумина