Автолиз мышечной ткани в асептических условиях
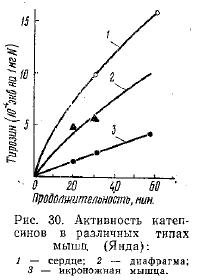
Катепсины были найдены в различных органах и тканях почти всех видов животных. Наиболее изучены катепсины селезенки, которые отличаются друг от друга по их отношению к сульфгидрильным активаторам. Янда показал, что протеолитическая катепсиновая активность в различных типах мышц неодинакова (рис. 30) и находится в прямой зависимости от степени их физиологической активности.
В соответствии с этим Бредли отмечает, что активные красные мускулы ноги цыпленка автолизируют значительно интенсивнее, чем неактивные грудные мускулы. Красные мускулы крупного рогатого скота, кролика и собаки обладают большей протеолитической активностью, чем белые мускулы птиц. Среди рыб соответственно наибольшей активностью обладает мышечная ткань скумбрии, 70% белков которой при .продолжительном автолизе подвергаются деструкции. В противоположность этому мышцы окуня, карпа и акулы характеризуются очень небольшими изменениями белков при автолизе.
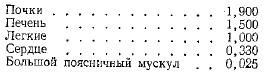
Цендер и сотрудники дают сравнительную характеристику протеолитической активности различных органов и тканей, экстрагированных 2%-ным раствором KCl (активность выражена в единицах увеличения оптической плотности при 279 ммк):
Низкая протеолитическая активность мышечной ткани может быть вызвана специфической устойчивостью белков мышечной ткани к действию указанных ферментов или незначительным количеством протеиназ в ткани. Подтверждением первого предположения является наличие в печени после продолжительного автолиза только 15% непереваренных склеропротеинов от их исходного количества, а в мышцах — 70% устойчивых к автолизу белков при проведении этого процесса в оптимальных условиях. В пользу второго предположения говорят полученные Цендером и сотрудниками данные о том, что при добавлении к мышечным экстрактам легкорасщепляемого протеолитическими ферментами субстрата не усиливается освобождение аминокислот.
В действительности, по-видимому, имеют значение оба фактора.
Идентичность катепсинов, содержащихся в различных органах и тканях животного организма, не доказана.
Выполненными исследованиями установлено наличие в мышечной ткани по крайней мере трех типов протеолитических ферментов.
К первому типу относится собственно катепсин, очевидно являющийся наиболее важным по своему действию на белки мяса.
Протеиназа мышечной ткани (катепсин) имеет оптимум pH при 3,8—4,5.
Снок и Нейрат сравнивали между собой протеолетическую активность различных типов экстрактов из мышц кроликов и установили, что различные экстрагенты по своей способности извлекать из мышц протеолитические ферменты располагаются в следующем порядке:
IMLiCl при pH 6,0 > 5,0% KCl при pH 6,0 > 2,0% KCl при pH 6,0 > 0,10 M фосфатный буфер pH 7,5 > вода > 0,15 M ацетатный буфер pH 4,5 > 0,15 M ацетатный буфер pH 4,0 + 0,6М KCl >50%-ный глицерин > 0,25 M H2SO4. Катепсин мышечной ткани инактивируется при pH 2,0—2,5 и его активность наиболее устойчива в интервале pH около 6,0. В течение одного часа инкубирования мышечных экстрактов при pH 6,0 сохраняется 85% первоначальной протеолитической активности, в то время как при pH 3,1 и 7,0 — только 46%. Достаточно полная инактивация катепсина наблюдается при нагревании мяса до 77° С в течение 20 мин. Вне зависимости от условий pH ферментативная активность катепсина повышается при диализе экстрактов. Это очевидно, связано с удалением продуктов автолиза, оказывающих угнетающее действие. Фермент индифферентен к редуцирующим веществам, цианиду и сульфгидрильным соединениям. Его активность повышается в присутствии солей Fe", Mn" и Mg, соли Ca, Zn и Co не оказывают на нее существенного влияния, а соли Ba — ингибируют.
Скорость ферментативного гидролиза при низкой концентрации фермента является линейной по отношению к продолжительности реакции и пропорциональной концентрации фермента.
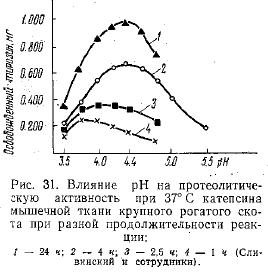
Изучение активности фермента при 37° С показало, что по мере увеличения продолжительности реакции увеличивается и оптимум pH (рис. 31). Вместе с этим по мере сдвига pH в кислую сторону повышается и оптимальная температура действия фермента (рис. 32). Эти данные указывают на вероятность предположения о наличии нескольких индивидуальных ферментов в исследовавшемся препарате.
Следует также отметить, что нативный коллаген при низких значениях pH (от 2,0 до 4,5) становится чувствительным к действию катепсина.
Установлено, что катепсин мышечной ткани крупного рогатого скота способен действовать также и при низких температурах.
Однако хранение облученного мяса при температуре 0—4° С в течение 7 месяцев в значительной мере позволяет задержать в нем автолитические процессы, протекающие под действием протеолитических ферментов. Уровень содержания аминокислот через 15 дней хранения при 38°С соответствует тому, который наблюдается только через 100 дней хранения при 25° С.
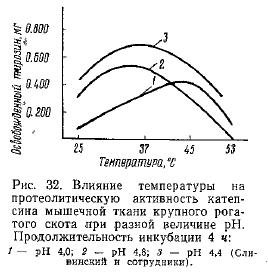
В противоположность этому Дворжак приходит к выводу: в процессе автолиза при 37° С количество свободных аминокислот почти не меняется, в то время как при 5° С наблюдается их увеличение и появление новых аминокислот: тирозина, фенилаланина и аспарагиновой кислоты.
Облучение дозой в 1,5 млн. фэр уменьшает протеиназную активность говяжьего мускула на 50%. При более низкой дозировке имелось лишь небольшое уменьшение протеиназной активности. В литературе имеются указания об уменьшении активности катепсина мышечной ткани крупного рогатого скота на 40—45% через 1 сутки после убоя животного, и на 62% через 5 суток. Эти данные не согласуются со свойствами катепсина, имеющего максимальную устойчивость при pH около 6,0.
В связи с этим вызывает сомнение применявшаяся автором методика: настаивание измельченной мышечной ткани различных, сравниваемых между собой сроков созревания с растворителем в течение 1 суток при комнатной температуре, добавление к вытяжкам перед их инкубированием и титрованием 0,2 н. щелочью растворов H2S (сероводородная вода), меняющих свою концентрацию при стоянии, и т. д.
Ко второму типу найденных в мышечной ткани протеолитических ферментов относится так называемая мышечная триптаза, имеющая оптимум pH в интервале 8,0—9,0. Опубликованы также сообщения о выделении из мышечной ткани ферментов, имеющих оптимум действия при pH 7,0 и pH 10,0. Свойства указанных ферментов изучены недостаточно.
И, наконец, третий тип протеолитических ферментов мышц составляют различные пептидазы с оптимумом pH в интервале от 7,6 до 8,0.
Мышечная ткань обладает высокой пептидазной активностью. Среди мышечных пептидаз не были найдены карбоксипептидаза и эндопептидазы, гидролизирующие несоседние с концевыми аминными и карбоксильными группами пептидные связи. Было установлено, что активность аминотрипептидазы, гидролизующей триглицин, в течение 15 дней процесса автолиза при 5° С не снижается. Этот же фермент обладал на протяжении всего процесса автолиза измеримой постоянной активностью при pH 5,7, в то время как активность остальных пептидаз наблюдалась только при pH 7,0—8,0.
По данным Смородинцева, измеренная при pH 8,0 активность пептидаз мышечной ткани крупного рогатого скота на десятый день хранения мяса при 4° С увеличивается в 2 1/2 раза по сравнению с исходной величиной. Аналогичные результаты, но с применением синтетических субстратов, получил Дворжак. Как отмечает автор, это указывает на освобождение данных ферментов в процессе автолиза. Пептидаза мышечной ткани, крупного рогатого скота активируется цистеином.

Цендер и сотрудники наблюдали почти полную дегенерацию волокон мышечной ткани ягнят, хранившейся при 25° С в течение 20—100 дней, и мускулов кроликов после 14 дней автолиза при 38° С (рис. 33). Однако эти же авторы сообщают, что мускулы свиней и овец через 35 дней хранения при 38° С имели не более 25% дегенерированных волокон. Шарп при длительном хранении мускулов кроликов и быков такой дегенерации волокон не наблюдал.
Как показали исследования, в течение 1 месяца хранения при 5 и 37° С диаметр мышечных волокон уменьшается от 200—260 до 14—86 мк и 43—170 мк соответственно. По другим морфологическим показателям также наблюдается существенная разница в ходе автолиза при этих двух температурных режимах. В процессе автолиза при 5° С распад преимущественно происходит поперек волокон, а при 37° С — вдоль. Остается без объяснения описанное автором необычное явление, заключающееся в том, что степень распада структуры ткани в течение 30 дней при 5° С была значительно большей, чем при 37° С. Таким образом, если судить об интенсивности протеолиза по накоплению конечных продуктов распада и количеству расщепленного белкового азота, то степень дезинтеграции мышечной структуры не зависит от величины этих показателей.
Наряду с этим во всех без исключения хранившихся образцах (даже через 172 дня хранения при 37° С) основная структура волокон и фибриллей оставалась неповрежденной и сохраняла поперечную исчерченность.
Немедленно после наступления окоченения и снижения величины pH в результате накопления молочной кислоты в мышцах начинаются протеолитические процессы, в результате которых содержание растворимого азота при 10-дневном автолизе мяса увеличивается с 10,5 до 13% от общего азота мяса. Одновременно происходит накопление небелкового азота (рис. 34). На процесс образования небелкового азота не оказывают влияния условия асептического хранения исследуемых образцов в атмосфере воздуха или азота.
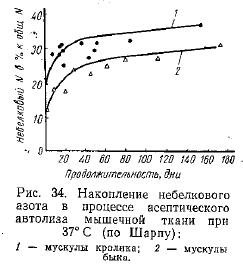
При этом интересно отметить, что скорость накопления небелкового азота в течение первых 10 дней асептического хранения при 37° в мускулах кроликов в два раза больше, чем в мускулах крупного рогатого скота, имеющих ту же конечную величину pH в интервале 5,5—5,8. В течение 5—6-месячного хранения при этих условиях содержание небелкового азота в указанных мускулах увеличилось с 10—13 до 31—37% от общего азота мяса.
Идентичность кривых, изображающих накопление амино-аммиачного азота и тирозина в процессе двухсотдневного асептического автолиза облученного мяса при различных температурах, свидетельствует об увеличении амино-аммиачного азота в основном за счет освобождения аминокислот. Значительное образование кристаллов тирозина три трехмесячном автолизе при 37° С облученного свиного мяса отмечали также Дрейк и сотрудники и другие авторы. При четырехмесячном автолизе мяса, облученного 1,5*10в6 рад, происходит резкое увеличение содержания всех свободных аминокислот, за исключением цистеина, содержание которого увеличивается незначительно. С увеличением дозы облучения активность катепсинов подавляется сильнее. В результате искусственного сдвига pH мяса от 5,6 до 7,2 протеолитические процессы при его длительном хранении не прекращаются, но их характер существенно изменяется. Несколько увеличивается освобождение цистина, сильно замедляется освобождение треонина, глицина, серина, β-аланина и особенно тормозится отщепление тирозина.
Накопление свободных аминокислот в экстракте сопровождается последовательным уменьшением растворимости белков в глициновом буфере (рис. 35).
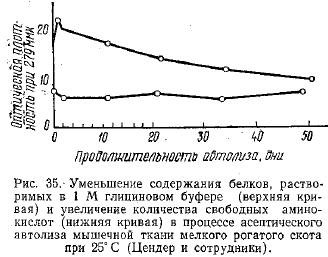
Через 1 месяц хранения мускулов быка при 37° С около 15% первоначального белкового азота становилось растворимым в трихлоруксусной кислоте (при 5° С — 4,4%), в то время как при 5° С количество растворимого в 0,1 M KCl белкового азота в течение этого срока не изменяется.
Автор выдвигает предположение, что все увеличение растворимого в трихлоруксусной кислоте азота происходит за счет распада саркоплазматических белков, а фибриллярные белки мышц в этом процессе не принимают участия.
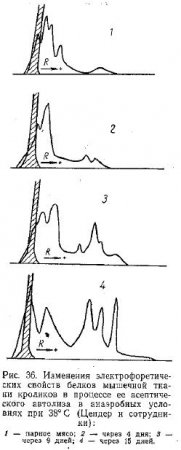
Цендер и сотрудники методом электрофореза обнаружили весьма интересные изменения свойств белков мышц мелкого рогатого скота и кроликов в процессе их асептического анаэробного автолиза. Экстракция белков из ткани и последующее их электрофоретическое разделение производились в 1 M глициновом буфере, имеющем pH 8,6. Это позволило изучить поведение не только саркоплазматических, но и миофибриллярных белков мышечной ткани.
Авторами выяснено, что характер электрофореграмм экстрагированных белков мышечной ткани мелкого рогатого скота изменяется только после 20-го дня хранения при 25° С. При этом появляются три новых пика. Мышцы кроликов ведут себя аналогичным образом, но разницу можно наблюдать в еще более поздние сроки — через 50—70 дней хранения при тех же условиях. Однако при 38° С они наступают уже через 9 дней (рис. 36). Через 15 дней автолиза мускулов кролика при 38° С новые белковые составные части, обнаруживаемые на электрофореграммах, достигают приблизительно половины общего количества белка в экстракте. Авторы считают, что их появление является результатом протеолитических изменений миофибриллярных белков. Появляющиеся в процессе автолиза новые белкозоподобные составные части мускулов характеризуются по их более высокой электрофоретической подвижности. Отсюда авторы выдвигают такое предположение: фибриллярные белки мышечной ткани в своем нативном состоянии относительно устойчивы при автолизе к действию протеолитических ферментов и не расщепляются до аминокислот или фрагментов, имеющих низкий молекулярный вес и растворимых в трихлоруксусной кислоте. Действие протеолитических ферментов приводит лишь к образованию указанных выше новых белковоподобных составных частей.
В течение 6-месячного асептического автолиза при 37° С мускулов кроликов а коллагеновой фракции белков соедини тельной ткани не было обнаружено никаких изменений, при водящих к образованию компонентов, растворимых в 0,1 M KCl.
Процессы, наблюдаемые в изолированной мышечной ткани при длительном асептическом автолизе в условиях повышенной температуры (25—37° С), ни в коем случае не могут служить характеристикой качественных и количественных изменений, происходящих при созревании мяса при низкой плюсовой температуре в производственных условиях.
Например, если в процессе асептического автолиза при 25°C изменения электрофоретических свойств миофибриллярных белков могут быть зарегистрированы только через 20 суток хранения, то, очевидно, при созревании мяса в течение двух недель при 0—4° С они будут совершенно неуловимы. Тем не менее, знание сущности процессов, происходящих при автолизе, может дать весьма ценные указания о (направлении, в котором должно вестись исследование. Кроме того, поскольку в производственных условиях бывает весьма трудно полностью исключить влияние микробиологического фактора, эти данные будут служить дополнительным доказательством автолитической природы наблюдаемых явлений.
- Тепловое окоченение и окоченение при оттаивании
- Особенности окоченения в различных мускулах и в мышечной ткани разных видов животных
- Изменения гидратации мышц
- Образование актомиозинового комплекса
- Распад АТФ и креатинфосфата
- Увеличение содержания ионов кальция в экстракте и инактивирование фактора Марша-Бендолла
- Амилолитический путь распада гликолена
- Гликолитические процессы после прекращения жизни животного
- Биохимические процессы в мясе животного после убоя
- Физические изменения мышц животного после убоя
- Микроскопическое строение мяса и его структурные изменения в процессах окоченения и созревания
- Химическая природа вещества, обусловливающих вкус и аромат мяса
- Факторы, определяющие нежность мяса
- Белковый состав мяса и отдельные свойства белков мышечной ткани
- Новое племенное хозяйство - репродуктор в Рязанской области
- Конференция «Мясного скотоводства» в Ленинградской области
- Разведение кроликов
- «Тамбовская индейка» - завершение возведения первой части объектов
- Рязанская область развивает сельские территории в комплексе
- Импортозамещение в венгерском стиле
- Новгородские специалисты увеличили производство мяса
- Белгородцев обеспечат фруктами и овощами
- Омский глава открыл комбикормовый завод
- Крымским производителям АПК частично возместят мелиоративные затраты
- Кировская область подвела итоги отбора объектов по проектированию автомобильных дорог
- Ставрополье разводит уникальных овец
- Ставрополью мало фруктов
- Троицкая система отпраздновала юбилей
- В Хабаровском крае заморозят цены
- Китай согласился купить челябинскую продукцию