Динамика показателей, характеризующих состояние миофибриллярных белков
Средние результаты выполненных опытов представлены в табл. 29. В ней показаны изменения растворимости белков фракции миозина в процессе созревания мяса при температуре 4° С.
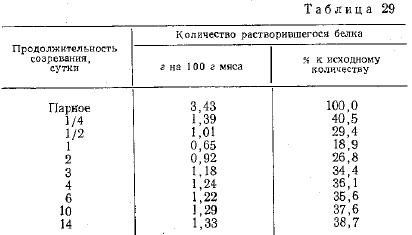
Как видно из этих данных, содержание в мясе переходящих в экстракт белков фракции миозина максимально сразу же после убоя животных (парное мясо). Уже через 6 ч после убоя отмечается отчетливо выраженный процесс перехода белков фракции миозина в нерастворимое состояние. Этот процесс последовательно углубляется вплоть до конца первых суток хранения, когда растворимость белков фракции миозина становится минимальной, достигая 19,0% к исходной величине.
После прохождения точки минимума начинается процесс последовательного увеличения растворимости белков фракции миознна, в результате которого величина этого показателя возрастает в среднем к концу четвертых суток до 36,0% к исходной величине, т. е. вдвое по сравнению с ее минимальным значением для мяса односуточного хранения. При дальнейшем увеличении продолжительности созревания до 14 суток при помощи этого метода не удалось выявить значительных изменений величины изучаемого показателя.
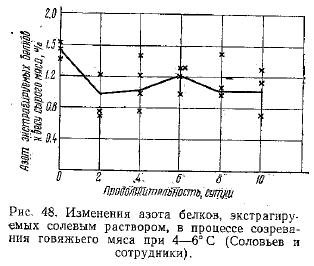
Поэтому в другой серии опытов мы попытались установить эти изменения, определяя азот белков, экстрагируемых солевым раствором, главным компонентам лабильной часта которых являются белки фракции миозина. Результаты этих опытов иллюстрированы кривой на рис. 48. По ним можно судить, что количество солерастворимых белков является максимальным в парном мясе, т. е. сразу после убоя животного. В течение первых двух суток хранения происходит резкое снижение этой величины — до 65% к азоту солерастворимых белков парного мяса.
Нa четвертые сутки происходит значительное увеличение растворимости белков в солевых растворах в среднем до 73% от их содержания в парном мясе. В некоторых опытах это увеличение продолжается до 6-х суток. К концу процесса (на 8-е и 10-е сутки) в отдельных опытах наблюдается некоторое уменьшение количества этих белков в среднем до 73—74% величины характерной для парного мяса. Однако это уменьшение в значительной мере лежит в пределах ошибки опыта. Эти опыты еще более отчетливо, чем предыдущие, выявили, что процесс увеличения количества белков, экстрагируемых солевым раствором (главную лабильную часть которых составляют белки фракции миозина), заканчивается к 4—6 суткам созревания.
Результаты этих исследований неоднократно подвергались проверке, причем применительно к различным условиям эксперимента методика исследования видоизменялась.
Большинство указанных авторов, за единственным исключением, подтвердили правильность последовательности процесса изменений миофибриллярных белков при хранении мышечной ткани различных животных при 0°С или при низкой положительной температуре и связь этих показателей с консистенцией мяса. Так, Головкин и Першина изучали динамику изменений растворимости и активности актомиозина при хранении рыб. Ими были установлены специфические особенности развития и расслабления окоченения у рыб по сравнению с теплокровными животными: в данном случае при расслаблении окоченения растворимость белков фракции миозина достигает, а иногда и превышает величину показателя для парной рыбы.
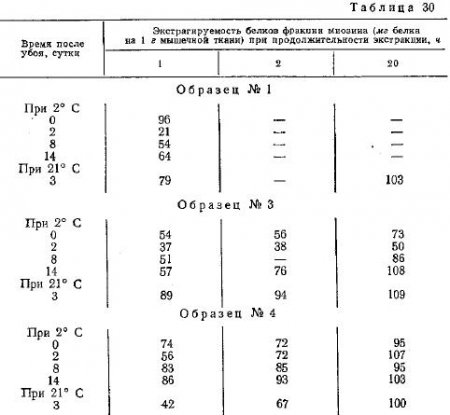
Локкер изучал изменения в состоянии белков фракции миозина по их растворимости в растворе Вебера-Эдсаля. Полученные им данные приведены в табл. 30. В ней показаны изменения экстрагируемости раствором Вебера-Эдсаля белков говяжьего мяса в процессе хранения при различной температуре.
Как видно из представленных данных, во всех случаях растворимость белков мышечной ткани в растворе Вебера-Эдсаля значительно возрастает вс второй фазе процесса созревания. Однако применение столь длительной экстракции и раствора Вебера-Эдсаля вместо 0,6 MKCl вряд ли является оправданным, так как при этих условиях не исключена возможность дополнительных изменений в состоянии белков фракции миозина.
Фуджимаки и Apаказа изучали изменение свойств миозина кроликов, телят, коров и лошадей, изолированного из мяса на разных стадиях процесса созревания. Результаты опытов по высаливанию сернокислым аммонием (растворов миозина В. полученных методом кратковременной экстракции, представлены на рис. 49.
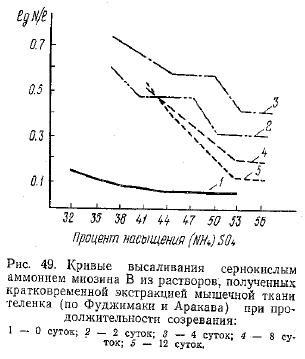
Как видно, содержание азота миозина в растворах увеличивается до 4 суток хранения (по наблюдавшимся срокам), а затем несколько снижается к концу хранения. Если исследуемое авторами парное мясо уже вступило в состояние окоченения, то все дальнейшие изменения находятся в соответствии с установленной выше закономерностью. Эти данные указывают также на различие свойств миозина В, выделенного из мяса на разных стадиях созревания. Стабилизация содержания азота в растворе при высаливании миозина достигается для парного мяса при 38—41% насыщения сернокислым аммонием, при 50% для мяса двухсуточного хранения и при 53% — для мяса 4—12-суточного. Таким образом, в процессе созревания миозин В становится более устойчивым к воздействию сернокислого аммония и, следовательно, при этом возможны изменения его структуры. При исследовании миозина В, полученного методом длительной экстракции, указанные различия сохранялись, но были выражены менее отчетливо.
Также изучались изменения ATФазной активности миозина, выделенного на различных стадиях созревания мяса различных видов животных. Однако данные различных авторов по этому вопросу весьма противоречивы. Для мышечной ткани крупного рогатого скота отмечается некоторое снижение АТФазной активности миозина в процессе охлаждения. По данным Пальмина и Алехиной, при продолжительном хранении облученной мышечной ткани снижение АТФазной активности находится в зависимости от сроков ее хранения. Ho даже через 40 суток хранения не наблюдалось полной инактивации ферментативных свойств миозина. Головкиным и Першиной, а также Павловским установлено некоторое увеличение ферментативной активности миозиновой АТФазы при замораживании мышечной ткани.
В процессе созревания оптимум pH АТФазной активности смещается в кислую сторону (от 7,1—7,3 до 6,2—6,7).
Локкеру не удалось установить качественных и количественных изменений электрофоретических свойств миофибриллярных белков в процессе двухнедельного хранения мяса при низкой плюсовой температуре. Это соответствует результатам опытов Цендера по асептическому автолизу, которыми установлено появление изменений только на 20-е сутки хранения при 25° С.
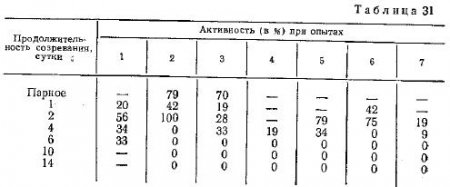
Как известно, величина падения вязкости раствора актомиозина после прибавления к нему АТФ характеризует его активность, т. е. содержание актина в испытуемом актомиозине. Результаты выполненных опытов показывают, что после более или менее значительных колебаний в течение первых двух суток хранения мяса при 0—4° С активность актомиозина к четвертым суткам снижается до 18%, а в некоторых опытах к этому сроку она достигает даже нуля. При дальнейшем увеличении продолжительности созревания до 6—14 суток она, как правило, равна нулю. Единственным исключением является мясо шестисуточного хранения в первом опыте, в котором активность составила 33%.
Таким образом, в процессе созревания мяса не происходит образования высокоактивного экстрагируемого актомиозина. Более того, на четвертые сутки экстрагируемые белки фракции миозина находятся преимущественно в форме диссоциированной на актин и миозин, а начиная с шестых суток экстрагируемый миозин совершенно не связан с актином в комплекс. Изменения активности актомиозина в процессе созревания мяса при 0—4° С показаны в табл. 31.
Нежность при этом продолжает увеличиваться до 10—12 суток хранения. Эти данные находятся в соответствии с выводами из выполненной в 1958 г. работы Фуджимаки и Аракава. Эти авторы установили, что специфическая вязкость растворов миозина В, полученного из мяса всех изучавшихся ими видов животных, существенно изменяется в процессе созревания. При этом чувствительность этих растворов к АТФ резко понижается и становится очень низкой. Кроме того, чувствительность к АТФ для растворов миозина В, полученных кратковременной экстракцией, выше, чем для растворов, получаемых при длительном настаивании.
На основании этих данных авторами сделано заключение: содержание актина в актомиозине резко снижается в процессе созревания мяса, в результате чего актомиозин, выделенный из созревшего мяса, становится похожим по своим свойствам на свободный миозин. Таким образом, выводы о наличии в мясе актомиозинового комплекса только в начальной стадии процесса созревания были подтверждены работой Фуджимаки и Аракава.
Данные о несовпадении по срокам увеличения растворимости белков фракции миозина и нежности мяса были впоследствии подтверждены Соколовым и Эль-Дашлуты при исследовании ими баранины.
Приведенные данные о накоплении небелкового азота и свободных аминокислот при созревании мяса, а также о сохранении активности катепсинов мышечной ткани на всем протяжении этого процесса указывают на возможность наличия протеолиза при хранении мяса при низких положительных температурах. Оставалось только неясным, каким изменениям при созревании подвергаются миофибриллярные белки под влиянием имеющихся в мясе протеиназ, иначе говоря, какова начальная стадия автолиза (протеолиза), в результате которой весьма существенно изменяются их физико-химические свойства. Органолептически же эти изменения воспринимаются как уменьшение жесткости мяса.
Отсюда возникла необходимость более детально изучить вопрос о начальной стадии протеолиза миофибриллярных белков в процессе созревания мяса и получить прямые доказательства протеолитических изменений, происходящих в них.
При этом особое внимание было обращено на белки фракции миозина, оказывающие, как известно, определенное влияние на жесткость мяса.
Для оценки возможных структурных изменений в белках фракции миозина мы определяли содержание в них N-концевых групп методом Сангера с внесенными в него изменениями.
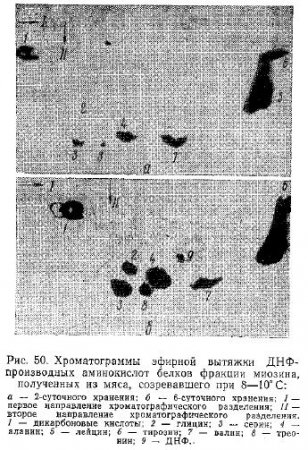
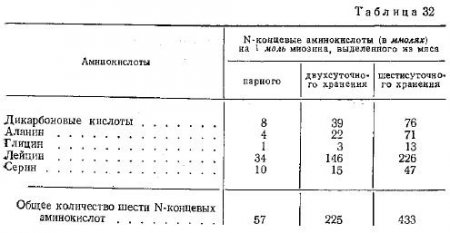
Результаты выполненных нами опытов приведены на рис. 50 и в табл. 32. В ней отражены изменения количества N-концевых аминокислот белков фракции миозина в процессе созревания мяса при температуре 8—10°C (средние данные 6 опытов).
В подавляющем большинстве случаев наблюдается последовательный значительный рост содержания N-концевых аминокислот в белках фракции миозина в процессе созревания мяса.
Выполненные опыты показали, что в белках фракции миозина в процессе созревания мяса всегда появляются N-концевые группы одних и тех же аминокислот. Причем в парном мясе они наблюдаются в виде следов или в незначительном количестве, а по мере увеличения продолжительности созревания появляются N-концевьте группы новых аминокислот и возрастает количество каждой из них.
В качестве N-концевых аминокислот белков фракции миозина, выделенных из мяса на различных стадиях его созревания, нами были идентифицированы дикарбоновые аминокислоты (глютаминовая и аспарагиновая), глицин, серии, аланин, лейцин, тирозин я треонин. Как видно из табл. 32, в процессе созревания последовательно возрастает количество каждой из изучавшихся N-концевых аминокислот и их сумма. Большинство этих групп белков фракции миозина, выделенных как из охлажденного (двухсуточного), так и созревшего (шестисуточного) мяса, приходится на лейцин и дикарбоновые кислоты (70—80%).
Таким образом, на всем протяжении созревания мяса, сопровождающегося увеличением его нежности, протекает процесс, выражающийся в разрыве пептидных связей в белках фракции миозина с образованием и накоплением в них свободных N-концевых групп лейцина, дикарбоновых кислот и некоторых других аминокислот. Эти данные являются подтверждением основной концепции Смородинцева о созревании мяса как автолитическом процессе.
При этом даже такое небольшое изменение в строении белковой молекулы, как расщепление нескольких пептидных связей, может обусловливать резкое изменение ряда физико-химических свойств этих белков, в том числе и жесткости мышечной ткани.
Приведенные результаты показывают, что после окончания развития окоченения, -во второй фазе процесса созревания при 8—10°С, одновременно с уменьшением жесткости мяса (см. таблицы 21, 22 и рис. 43) наблюдается увеличение степени его гидратации (см. рис. 40) и способности удерживать влагу при тепловой обработке (см. рис. 42). Вместе с тем N-концевые группы в белках фракции миозина накапливаются в те же сроки созревания мяса. Следовательно, рассматриваемые явления взаимосвязаны.
Мы полагаем, что эти данные проливают некоторый свет на причины установленного Детерейджем и Вербицким связывания катионов белками при созревании мяса. Действительно, отмеченное накопление в белках фракции миозина N-концевых групп ряда аминокислот неизбежно сопровождается соответствующим увеличением количества свободных карбоксильных (С-концевых) групп в белковой молекуле. Это увеличение содержания свободных карбоксильных групп и приводит при созревании мяса к связыванию белками дополнительных количеств катионов.
Очевидно, причина связывания белками ионов при созревании мяса — протеолитические изменения в структуре белков фракции миозина.
Так как хранящееся в производственных условиях мясо не всегда является стерильным, имелось некоторое сомнение в автолитической природе описанного явления.
Для разрешения этого сомнения были выполнены дополнительные опыты по изучению содержания N-концевых групп в белках фракции миозина, выделенных из говяжьего мяса, облученного стерилизующими дозами гамма-излучений.
Исследовалась необлученная и облученная мышечная ткань коров на разных стадиях автолиза. До облучения образцы хранились при температуре 2—4°С, тормозящей развитие автолитических процессов. Перед облучением мышечная ткань измельчалась на мясорубке и герметически упаковывалась в консервные банки порциями по 250 г. Облучение проводилось на установке Co60 мощностью 900—1300 рад/сек. Доза облучения 5*10в6 рад обеспечивала стерильность исследуемых образцов. После облучения образцы хранились при комнатной температуре до 60 суток.
Полученные данные подтвердили прежние результаты.
В белках фракции миозина автолизирующей облученной мышечной ткани, как и необлученной, всегда обнаруживаются N-концевые группы одних и тех же аминокислот: глицина, серина, аланина, лейцина, дикарбоновых аминокислот, тирозина и валина.
Выполненные исследования дают возможность сделать такие выводы: 1) необоснованными являются утверждения некоторых авторов о том, что при автолизе происходит гидролиз только белков саркоплазмы, а миозин не затрагивается протеолитическими ферментами мышечной ткани; 2) образование и накопление N-концевых групп должно быть отнесено исключительно за счет автолитических процессов, стимулируемых катепсинами мышечной ткани; 3) основной процесс, происходящий при созревании мяса и выражающийся в изменении ряда физико-химических свойств белков мяса, воспринимаемом органолептически как уменьшение его жесткости, следует рассматривать как начальную стадию протеолиза фибриллярных белков мышечной ткани под воздействием катепсинов.
- Динамика показателей, характеризующих состояние саркоплазматических белков
- Изменения в белковой системе мяса в целом
- Физико-химические изменения в процессе созревания мяса
- Микробиологические изменения в процессе созревания мяса
- Органолептические изменения при созревании мяса
- Автолиз мышечной ткани в асептических условиях
- Тепловое окоченение и окоченение при оттаивании
- Особенности окоченения в различных мускулах и в мышечной ткани разных видов животных
- Изменения гидратации мышц
- Образование актомиозинового комплекса
- Распад АТФ и креатинфосфата
- Увеличение содержания ионов кальция в экстракте и инактивирование фактора Марша-Бендолла
- Амилолитический путь распада гликолена
- Гликолитические процессы после прекращения жизни животного
- Биохимические процессы в мясе животного после убоя
- Физические изменения мышц животного после убоя
- Микроскопическое строение мяса и его структурные изменения в процессах окоченения и созревания
- Химическая природа вещества, обусловливающих вкус и аромат мяса
- Факторы, определяющие нежность мяса
- Белковый состав мяса и отдельные свойства белков мышечной ткани
- Новое племенное хозяйство - репродуктор в Рязанской области
- Конференция «Мясного скотоводства» в Ленинградской области
- Разведение кроликов
- «Тамбовская индейка» - завершение возведения первой части объектов
- Рязанская область развивает сельские территории в комплексе
- Импортозамещение в венгерском стиле
- Новгородские специалисты увеличили производство мяса
- Белгородцев обеспечат фруктами и овощами
- Омский глава открыл комбикормовый завод
- Крымским производителям АПК частично возместят мелиоративные затраты