Динамика показателей, характеризующих состояние белковых компонентов внутримышечной соединительной ткани
Единодушна оценка самого устойчивого компонента соединительной ткани — эластина: созревание не оказывает на него существенного влияния. Однако эта точка зрения до настоящего времени не подтверждена биохимическими исследованиями.
Штейнер высказывал предположение о том, что уменьшение жесткости говяжьего мяса в течение первых четырех или пяти дней хранения вызывалось главным образом изменениями в мышечных волокнах. Изменения в соединительной ткани, вызванные автолизом или другими причинами, по мнению автора, оказывали влияние на нежность говяжьего мяса только после продолжительного хранения, т.е. через 20 или 30 дней. Отсюда Штейнер сделал вывод: соединительная ткань играет лишь второстепенную роль в улучшении консистенции говяжьего мяса при его хранении.
В дальнейшем этот вопрос изучался Прудент, Уайнгарденом и сотрудниками, Вербицким и сотрудниками и др.
Все они пришли к единодушному мнению: после прекращения жизни животного не происходит такого распада соединительной ткани, который бы вызывал уменьшение содержания в мясе коллагена и эластина и коррелировался с изменением нежности.
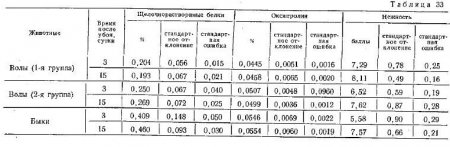
В табл. 33 приведены результаты работ Вербицкого и сотрудников о послеубойных изменениях нежности мяса и количества содержащегося в нем коллагена.
Авторы исходили из предпосылки, что жесткость мяса обусловлена только содержанием в нем соединительной ткани. Если она уменьшается, это должно означать, что белки соединительной ткани под действием ферментов гидролизуются, и поэтому содержание коллагена должно также уменьшаться.
Полученные данные показали необоснованность этого утверждения, так как в процессе созревания мяса не имеет место такой распад соединительнотканых белков, который бы приводил к уменьшению их содержания, коррелирующегося с изменением нежности. К аналогичному заключению пришли и другие исследователи.
Однако это не исключает того, что содержание коллагена оказывает влияние на начальную нежность мяса на 3-й день после убоя, а указывает лишь на то, что степень корреляции между этими двумя (показателями к 13-му дню созревания значительно уменьшается.
Некоторые авторы (Детерейдж и Харшам, Хусаини и сотрудники) признают (влияние двух факторов на изменение нежности мяса в процессе его созревания: белки соединительной ткани и белки мышечной плазмы. Причем последние ими рассматриваются как фактор первостепенной важности.
В изданном и США под редакцией Гиллеспай руководстве «The Science of meat and meat producis» имеется ссылка на следующие неопубликованные данные Ванга, полученные гистохимическим методом: коллагеновая соединительная ткань не подвергавшегося хранению мяса однородно окрашивается в красный цвет кислым фуксином. По мере увеличения сроков хранения наблюдается потеря этой способности: остается только сродство к пикриновой кислоте (желтый цвет). Измеряя плотность окраски срезов фотометрически, Ванг определил, что имеется общее прогрессивное уменьшение способности коллагеновой соединительной ткани к окрашиванию кислым фуксином в различных мышцах (полусухожильной, длиннейшей спины), созревавших в течение 28 дней. При этом скорость, с которой шел процесс, была неодинакова для разных мышц. Так, исходная интенсивность окраски фуксином коллагеновой соединительной ткани полусухожильной мышцы в три раза превышала величину этого показателя для длиннейшей мышцы спины. После 28 дней созревания это отношение было уже только 2:1, Кроме того, потеря сродства коллагеновой ткани к фуксину в отдельных случаях была выше в течение первых двух недель хранения по сравнению с двумя последующими.
Хотя данные, полученные Вангом, являются очень важными, они дают возможность только наблюдать структурные изменения ткани, но не вскрывают их сущности и не объясняют природы наблюдаемых превращений.
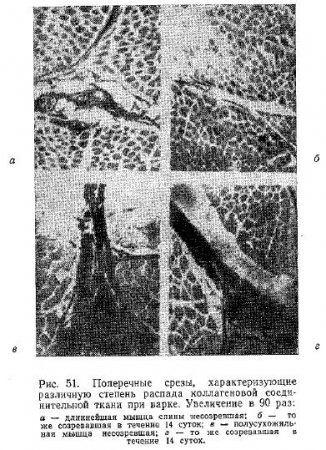
В «The Science of meat and meat products» приводятся также гистологические данные, свидетельствующие об изменении коллагеновой соединительной ткани в различных мышцах при созревании и последующей варке мяса. Отмечается, что в некоторых случаях потери коллагена после варки полусухожильной мышцы, которая созревала в течение 14 дней, были вдвое больше, чем при варке того же, но несозревшего мяса. Воспроизводя те же экспериментальные условия для длиннейшей мышцы спины, авторы получили несколько меньшие потери коллагена в свежей ткани по сравнению с созревшей. Рис. 51 иллюстрирует данные этих исследований.
Авторы квалифицируют наблюдаемое явление как убыль в содержании коллагена, но мы не можем согласиться с этими выводами, так как способность коллагеновой соединительной ткани к окрашиванию тем или иным красителем может зависеть и от незначительных структурных изменений, нарушения отдельных связей, присоединения ионов и других причин. Кроме того, остается невыясненным, относится ли это изменение к собственно коллагену или к коллагеновой соединительной ткани, включающей в себя основное вещество.
Последующие работы подтвердили биохимическими методами результаты наблюдений и позволили до некоторой степени вскрыть сущность наблюдаемых изменений.
В табл. 34 приведены данные об изменениях лабильности фибриллярных компонентов внутримышечной соединительной ткани в процессе созревания мяса при 8—10°С (средние данные из 7 серий опытов).
При рассмотрении этих данных прежде всего следует отметить, что развариваемость коллагена парного мяса достигает в среднем 23,2% от его исходного содержания в неподвергавшихся тепловой обработке образцах мяса.
Величина этого показателя значительно уменьшается в первой стадии хранения мяса и через двое суток составляет в среднем всего 15,0%. При дальнейшем хранении, во второй фазе созревания, развариваемость коллагена снова возрастает (в среднем до 22,3%, а в отдельных образцах мяса этот процент даже выше).
Таким образом, с большой достоверностью можно сказать, что развариваемость коллагена изменяется на всех этапах наблюдаемого периода хранения мяса, имея отчетливо выраженный минимум в стадии послеубойного окоченения.
Учитывая большое значение этой закономерности для правильного понимания сущности послеубойных биохимических процессов была предприняты попытки вскрыть ее причины. Для этого исследовалась лабильность отдельных компонентов внутримышечной соединительной ткани.
При оценке лабильности фибриллярных компонентов внутримышечной соединительной ткани выявлено, что солерастворимая фракция, полученная путем экстрагирования измельченного мяса 0,6 M раствором KCl, не содержит оксипролина. Поэтому при изучении лабильности содержащегося в мясе коллагена анализировались его фракции: щелочерастворимая, растворимая при автоклавировании и нерастворимая при автоклавировании.
Как видно из табл. 34, в процессе созревания мяса не наблюдается значительных изменений в экстрагируемости 0,1 M раствором щелочи содержащих оксипролин (ОП) белков. Однако при этом преобладающей является тенденция нарастания данной фракции в процессе 6-суточного хранения мяса при 8—10°C.
Автоклавирование с водой остатка после щелочной экстракции в заданных условиях дает возможность извлечь в водный экстракт большую долю коллагена. Она неодинакова для парного, двух- и шестисуточного мяса, и коллаген с большей или меньшей легкостью переходит при автоклавировании в раствор в зависимости от срока хранения мяса. Так, при переходе от парного состояния мяса к двухсуточному в растворимую при автоклавировании фракцию извлекается меньше коллагена, а от двухсуточного мяса к шестисуточному — количество коллагена в этой фракции снова несколько возрастает.
Обратная картина наблюдается во фракции белков, нерастворимых при данных условиях автоклавирования. Остаток после отделения экстракта, полученного автоклавированием с водой и последующей промывки, не представляет собой чистого эластина: он содержит некоторое количество коллагена и тем больше, чем менее лабилен этот белок.
По-видимому, наблюдаемые изменения фибриллярных компонентов внутримышечной соединительной ткани при хранении парного мяса в течение 2 суток выражаются как переход:
1) растворимой при автоклавировании фракции в нерастворимую;
2) растворимой при автоклавировании фракции в щелочерастворимую.
При этом первый процесс является преобладающим.
При дальнейшем хранении мяса до 6 суток эти изменения выражаются как переход:
1) нерастворимой при автоклавировании фракции коллагена в растворимую,
2) растворимой при автоклавировании фракции в щелочерастворимую.
И опять первый процесс является преобладающим.
Полученные результаты исследования лабильности фибриллярных компонентов подтверждают установленную закономерность изменений развариваемости коллагена и данные о наблюдаемых гистологическим методом изменениях соединительной ткани при созревании мяса.
Итак, структурные белки внутримышечной соединительной ткани становятся менее лабильными при переходе от парного состояния мяса к двухсуточному, и их лабильность увеличивается при созревании мяса в течение 6 суток при 8—10°С.
Учитывая данные Мак Интош о содержании в солерастворимой фракции гексозаминов (ГА), связанных с белками плазмы (т. е. не принадлежащих компонентам соединительной ткани), за индекс основного вещества принимают количество гексозаминов в остатке после экстракции 0,6 M раствором KCl.
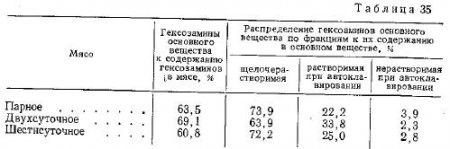
Изменения основного вещества внутримышечной соединительной ткани полусухожильной мышцы и его лабильности в процессе созревания мяса при температуре 8—10°C (среднее из 7 серий опытов) показаны в табл. 35.
Как видно из табл. 35, переход от парного состояния мяса к двухсуточному сопровождается некоторым увеличением (в среднем на 5,6%)' количества гексозаминсодержащих соединений, определяемых как основное вещество. В ходе дальнейшего созревания мяса (к 6 суткам) наблюдается уменьшение количества этого компонента во внутримышечной соединительной ткани (в среднем до 60,8%).
Следовательно, в мясе при его хранении имеют место процессы, сопровождающиеся изменениями растворимости гексозаминсодержащих компонентов основного вещества внутримышечной соединительной ткани. Результаты исследования лабильности основного вещества путем его фракционирования на так называемые легкорастворимые (растворимые в 0,1 N растворе NaOH) и труднорастворимые (растворимые при автоклавировании) гексозаминсодержащие компоненты подтверждают наличие таких изменений.
В зависимости от срока хранения мяса распределение гексозаминов по этим фракциям изменяется следующим образом: на первой стадии хранения мяса (двухсуточное) рост содержания основного вещества сопровождается одновременным уменьшением его лабильности. Она определяется по растворимости гексозаминсодержащего компонента в 0,1 N NaOH, а также при автоклавировании остатка после щелочной экстракции. Эта стадия характеризуется тем, что в мясе еще сохраняются признаки окоченения и не наступило его полное расслабление.
Во второй фазе созревания мяса (шестисуточное), когда в мясе преобладают деструкционные процессы, приводящие к улучшению его консистенции, эти изменения носят прямо противоположный характер.
Взаимосвязь между нежностью мяса, развариваемостью коллагена, содержанием основного вещества и лабильностью компонентов внутримышечной соединительной ткани представлена на диаграммах, изображенных на рис. 52.
Корреляционная связь наблюдаемых изменений была установлена между изменениями нежности (по Гамму) и лабильности основного вещества. Это указывает на то, что нельзя исключить влияние компонентов внутримышечной соединительной ткани на упруго-пластические свойства мяса. Вычисления коэффициентов корреляции между содержанием гексозаминов щелочерастворимой фракции и показателем нежности мяса указывают на взаимосвязь этих величин как в первой, так и во второй фазах созревания. Величина развариваемости коллагена внутримышечной соединительной ткани находится в обратной зависимости от изменения содержания основного вещества.
Следовательно, на консистенцию мяса в n-роцессе его созревания оказывают влияние как содержание мукопротеинов во внутримышечной соединительной ткани, так и их состояние. Об этом свидетельствует высокое значение коэффициентов корреляции между изменениями общего количества основного вещества и его лабильности, с одной стороны, и показателей, характеризующих консистенцию мяса (нежность сырого мяса и развариваемость коллагена), — с другой.
При наступлении посмертного окоченения и контракции мышечных волокон изменения основного вещества внутримышечной соединительной ткани, вероятно, могут протекать в направлении его полимеризации.
Выше было показано, что при наступлении окоченения имеет место уменьшение водосвязывающей способности белков мышечной ткани и освобождающаяся при контракции вода должна, по-видимому, фиксироваться иным механизмом. С этой точки зрения основное вещество соединительной ткани является весьма мобильным и может рассматриваться как дополнительный резерв для частичного связывания воды.
Исследованиями Видберга установлено: при повышении степени полимеризации мукополисахаридов основного вещества ими удерживается большее количество воды. На вторые сутки хранения мяса нами отмечается увеличение доли гексозаминов в основном веществе внутримышечной соединительной ткани. На основании этого предполагается возможность образования при посмертном окоченении мукопротеинов более высокой степени полимеризации.
До настоящего времени развитие посмертного окоченения рассматривалось только с точки зрения изменений мышечных белков (миозина).
Полученные нами данные указывают на возможность участия в этом процессе также основного вещества внутримышечной соединительной ткани.
Во второй стадии созревания мяса преобладающими являются автолитические процессы, приводящие к деструкции отдельных компонентов животной ткани.
Приведенные выше результаты свидетельствуют о том, что эти же процессы имеют место и в основном веществе внутримышечной соединительной ткани, благодаря чему увеличивается количество гексозаминов, экстрагируемых с белками плазмы, а лабильность мукопротеинов основного вещества увеличивается.
Таким образом, биохимические процессы в основном веществе внутримышечной соединительной ткани во второй фазе созревания мяса протекают по следующей схеме:
Причины изменений лабильности основного вещества нами полностью еще не вскрыты. Однако есть основания считать, что в превращениях этого компонента во второй фазе созревания принимают участие факторы, приводящие к деструкции мукопротеинов, в частности ферменты, обладающие мукопротеиназной или протеолитической активностью, о чем будет сказано ниже.
Таким образом, наши исследования компонентов внутримышечной соединительной ткани, изменений развариваемости коллагена и нежности в процессе созревания мяса (рис. 52) доказывают правильность предположений прежних исследователей о зависимости жесткости мяса не только от количества, но и от состояния соединительной ткани. При этом состояние основного вещества внутримышечной соединительной ткани в некоторой мере определяет гидротермическую устойчивость коллагена, а следовательно, и жесткость подвергнутого тепловой обработке мяса.
- Динамика показателей, характеризующих состояние миофибриллярных белков
- Динамика показателей, характеризующих состояние саркоплазматических белков
- Изменения в белковой системе мяса в целом
- Физико-химические изменения в процессе созревания мяса
- Микробиологические изменения в процессе созревания мяса
- Органолептические изменения при созревании мяса
- Автолиз мышечной ткани в асептических условиях
- Тепловое окоченение и окоченение при оттаивании
- Особенности окоченения в различных мускулах и в мышечной ткани разных видов животных
- Изменения гидратации мышц
- Образование актомиозинового комплекса
- Распад АТФ и креатинфосфата
- Увеличение содержания ионов кальция в экстракте и инактивирование фактора Марша-Бендолла
- Амилолитический путь распада гликолена
- Гликолитические процессы после прекращения жизни животного
- Биохимические процессы в мясе животного после убоя
- Физические изменения мышц животного после убоя
- Микроскопическое строение мяса и его структурные изменения в процессах окоченения и созревания
- Химическая природа вещества, обусловливающих вкус и аромат мяса
- Факторы, определяющие нежность мяса
- Белковый состав мяса и отдельные свойства белков мышечной ткани
- Новое племенное хозяйство - репродуктор в Рязанской области
- Конференция «Мясного скотоводства» в Ленинградской области
- Разведение кроликов
- «Тамбовская индейка» - завершение возведения первой части объектов
- Рязанская область развивает сельские территории в комплексе
- Импортозамещение в венгерском стиле
- Новгородские специалисты увеличили производство мяса
- Белгородцев обеспечат фруктами и овощами
- Омский глава открыл комбикормовый завод