Белковый состав мяса и отдельные свойства белков мышечной ткани
Предложенная Гекели модель мышечной фибриллы дает достаточно простое объяснение большинству изменений поперечной исчерченности мышц и устанавливает связь между гистологическим строением и химическим составом мышцы. Согласно этой модели основу мышечной фибриллы составляют актиновые филаменты, которые занимают пространство от Z-линии до начала Н-зоны, где они прикрепляются к эластическому компоненту.
Миозиновые филаменты занимают пространство от одного конца A-полосы, через всю Н-зону, до другого ее конца. Согласно представлениям Гекели, длина последних филаментов не изменяется при сокращении. Таким образом, миозиновые и актиновые филаменты в A-полосе находятся рядом один с другим. Актиновые филаменты присоединяются к миозиновым филаментам в центре A-полосы при помощи поперечных связей. Предполагается, что при сокращении мышцы происходит «скольжение» нитей актина в промежутках между нитями миозина. Этот процесс начинается в результате взаимодействия групп актина, активированных аденозинтрифосфорной кислотой (АТФ), с функциональными группами миозина. Схема дает наглядное представление о взаимосвязи между структурными белками в живом мускуле. Однако она не может объяснить происходящие при послеубойном окоченении процессы, поскольку образующиеся при этом и наблюдаемые под микроскопом узлы и волны окоченения несоизмеримы с размерами элементов, которые составляют миофибриллу.
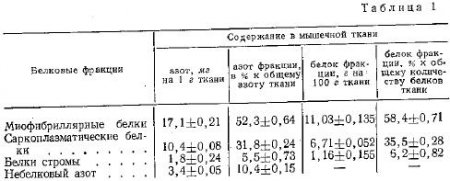
Предпринимались многочисленные попытки фракционировать белки мышечной ткани и установить, в каком соотношении входят в ее состав различные белки. В зависимости от условий экстрагирования получаются результаты, в значительной мере отличающиеся друг от друга. Эти работы имели общий недостаток — около 15—20% общего количества мышечных белков оставалось неэкстрагированными. Сравнительно недавно Хеландером была предложена новая схема фракционирования мышечных белков. По этой схеме анализа экстрагируется около 95% содержания азота в ткани. Распределение белков мышечной ткани кролика по фракции (по Хеландеру) характеризует табл. 1.
Эти данные относятся к мышечной ткани, изъятой из организма немедленно после прекращения жизни животного. Как будет показано ниже, послеубойные изменения вносят существенные коррективы в соотношение белковых фракций мышечной ткани.
Фракция саркоплазматических водорастворимых белков (миоген, миоглобин, миоальбумин, глобулин X, нуклеопротеиды) характеризуется глобулярным строением своих молекул. Белки этой фракции принимают лишь косвенное участие в акте мышечного сокращения и послеубойных изменениях консистенции мяса. Последнее обусловлено наличием у них ряда ферментативных свойств. Фракция стромы включает главным образом белки внутримышечной соединительной ткани (коллаген, эластин, мукопротеины основного вещества), нерастворимые в солевых растворах. Они имеют весьма существенное значение в придании мясу жесткости. Поэтому изучение их количественного содержания и качественного состояния в мясе представляет значительный интерес для биохимии пищи и питания.
Миофибриллярные белки (миозин, актин, актомиозин и др.) ввиду исключительной роли, которую они играют в акте мышечного сокращения, часто называют также сократительными, или контрактильными белками. Большинство из них растворяется только в солевых растворах.
В последующих главах дается изложение их значения в развитии процессов послеубойного окоченения и его расслабления, вызывающего увеличение нежности при созревании мяса.
В литературе имеются сообщения о выделении из мышечной ткани новых миофибриллярных белков. Однако их индивидуальность не во всех случаях окончательно доказана. Все же при изучении свойств белковых фракций, экстрагированных из мышечной ткани солевыми растворами различной ионной силы, следует принимать во внимание возможность влияния этих белков на получаемые результаты.
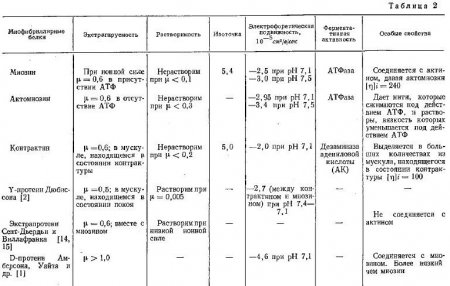
В табл. 2, заимствованной из работы Марко-Ребер, приведены некоторые свойства указанных белков. Представляет интерес сообщение Амберсона и сотрудников о выделении ими D-протеина. Он экстрагируется при значительно большей ионной силе солевых растворов, чем миозин и актомиозин, обладает способностью соединяться с миозином и образует более вязкие растворы, чем последний. С другой стороны, следует отметить Y-протеин Дюбиссона и экстрапротеин Сент-Дьердьи и Виллафранка. Эти белки, экстрагируясь из мышечной ткани приблизительно при одинаковых условиях с миозином, отличаются от него своей способностью растворяться при очень низкой ионной силе солевых растворов.
Метамиозин был выделен Марко-Ребер из мышц эмбрионов кроликов и баранов. Поданным авторов, его количество уменьшается в процессе эмбрионального развития в у взрослых животных он содержится только в виде следов. Поэтому в мясе молодых животных может оказаться белок, имеющий близкие к миозину свойства экстрагируемости и растворимости в солевых растворах, но не обладающего способностями соединяться с актином и расщеплять АТФ.
Данные о свойствах миофибриллярных белков даны в табл. 2.
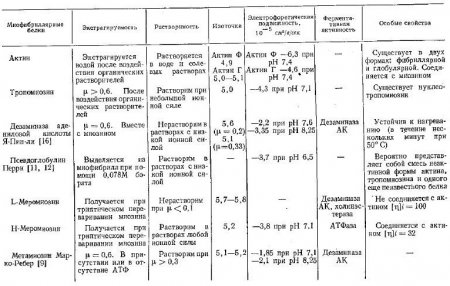
Следует более подробно остановиться на свойствах меромиозинов.
Многими исследователями было показано, что трипсин, химотрипсин и субтилопелтидаза быстро изменяют миозин, образуя водорастворимый материал без какой-либо потери АТФазной активности.
Гергели получил при этом две фракция: одну растворимую и другую нерастворимую принивкой ионной силосолевых растворов. При этом большинство АТФазной активности оставалось в растворимой фракции.
Сент-Дьердьи изучил свойства этих компонентов и назвал продукт, имеющий молекулярный вес 230 000, Н-меромиозином, а меньший MB (100000) L-меромкозином.
Изучая их физические свойства, Сент-Дьердьи установил, что растворимости L-меромиозина и миозина практически одинаковы в KCl и (NH4)2SO4. Н-меромиозин не осаждается при низких концентрациях КСl и растворяется в воде. Кроме того, он осаждается при более высоких концентрациях (NH4)2SO4 (45—55% насыщения), чем миозин и L-меромиозин (30—40% насыщения).
Растворимость расщепленного трипсином миозина представляет собой сумму растворимостей указанных компонентов. По этой причине после кратковременного (12-минутного) воздействия трипсина на миозин при pH 8,8 в воде растворяется свыше 60% белка.
Из данных Коминца и других, об аминокислотном составе белков фракции миозина можно сделать такой вывод: при делении молекулы миозина значительные количества содержащийся в нем глютаминовой кислоты и аргинина переходят в L-меромиозин, а фенилаланина, глицина и пролипа — в П-меромиозин.
В результате этого L-меромиозин по сравнению с миозином содержит больше глютаминовой кислоты и аргинина и меньше фенилаланина, глицина и пролина.
Для Н-меромиозина наблюдается противоположная зависимость. Миддльбрук при помощи метода Сангера проверил содержание N-концевых групп в L-меромнозине, образованных действием трипсина, химотрипсина и субтилопептидазы. При этом было установлено наличие в нем следов более чем 10 N-концевых остатков, составляющих в сумме не более 2 экв на 1 моль белка.
Автором была также показана возможность дегюлимеризировать L-меромиозин в 5М растворе мочевины и таким путем приблизительно в 10 раз увеличить в нем количество N-концевых групп.
Ниже приведено содержание N-концевых групп в деполимезированном L-меромиозине (средний MB цепи 5.000) (табл. 3).
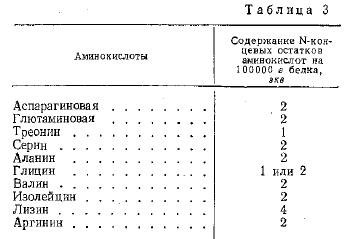
Автор отмечает, что результаты всегда получаются одни и те же, независимо от применявшегося фермента.
При обработке L-меромиозина карбоксипептидазой А освобождаются следующие С-концевые аминокислоты в количестве от 1 до 2 экв на 1 молекулу: аспарагиновая кислота, треонин, серин, аланин, глицин, валин, изолейцин, фенилаланин, гистидин и тирозин.
Лаки пришел к выводу, что меромиозины являются продуктами протеолитического расщепления миозина и не должны рассматриваться в качестве предсуществующих в миозине субчастиц.
Представляют также интерес сведения о том, с какими компонентами мышечной ткани связаны ионы щелочноземельных металлов и адениннуклеотиды.
Из данных Хассельбаха видно, что 60% мышечного кальция, 10% магния и 5% аденина связаны структурными белками мышц. Кроме того, аденин в форме АДФ связывается почти исключительно актином; 60% содержащегося в фибриллах кальция также связано актином, 35% — миозином и 5% — белками стромы. Содержание магния в актине и L-миозине приблизительно одинаковое. Несвязанный структурными белками кальций в количестве 65% удерживается граной, а 35% (или менее 15% общего количества) удаляется из мышечной ткани вместе с водорастворимой фракцией. Таким образом, эти данные подчеркивают значение актина в связывании ионов щелочноземельных металлов и адениннуклеотида.
- Новое племенное хозяйство - репродуктор в Рязанской области
- Конференция «Мясного скотоводства» в Ленинградской области
- Разведение кроликов
- «Тамбовская индейка» - завершение возведения первой части объектов
- Рязанская область развивает сельские территории в комплексе
- Импортозамещение в венгерском стиле
- Новгородские специалисты увеличили производство мяса
- Белгородцев обеспечат фруктами и овощами
- Омский глава открыл комбикормовый завод
- Крымским производителям АПК частично возместят мелиоративные затраты
- Кировская область подвела итоги отбора объектов по проектированию автомобильных дорог
- Ставрополье разводит уникальных овец
- Ставрополью мало фруктов
- Троицкая система отпраздновала юбилей
- В Хабаровском крае заморозят цены
- Китай согласился купить челябинскую продукцию
- Самарчане вручили награды лауреатам общественной акции
- Кубанские страусы помогают с изготовлением сумочек Gucci и Armani
- В Красноярском крае будут производить больше индюшиного мяса
- Нидерланды поставляли в РФ контрабандную свинину под видом овощей и соков
- Россельхознадзор запретил свинину с Минского мясокомбината
- Правительство выдало ряд поручений по развитию животноводства
- В Тульской области создается ассоциация по содействию развитию пчеловодства
- Подпрограмма развития молочного скотоводства начнет работать в России с 2015 года
- Расширить ассортимент готовой продукции в рамках импортозамещения
- Минсельхоз предлагает финансировать новые проекты в животноводстве из ФНБ
- На российском рынке могут появиться креветки из Никарагуа
- Россельхознадзор может разрешить поставки в Россию мяса диких антилоп из Африки
- В Липецкой области будет построено три кролиководческих мини-фермы
- На столе россиян появится крокодилятина